Alluminio nel tessuto cerebrale dei soggetti autistici

Journal of Trace Elements in Medicine and Biology
Autori: Matthew Mold, Dorcas Umar, Andrew King, Christopher Exley
26 November 2017
Abstract
Il disturbo dello spettro autistico è un disturbo dello sviluppo neurologico di eziologia (causa) ignota. Viene suggerito che la causa coinvolga sia una suscettibilità genetica che dei fattori ambientali, tra i quali vanno incluse alla fine anche le tossine ambientali. È stato fatto il tentativo di legare l’esposizione umana alla tossina ambientale alluminio al disturbo dello spettro autistico. Qui abbiamo utilizzato la tecnica della transversely heated graphite furnace atomic absorption spectrometry (spettrometria di assorbimento atomico da fornace di grafite riscaldata trasversalmente) per misurare, per la prima volta, il contenuto di alluminio del tessuto cerebrale di soggetti donatori con una diagnosi di autismo. Abbiamo anche utilizzato del fluoro selettivo per l’alluminio per identificare l’alluminio nel tessuto cerebrale utilizzando la microscopia a fluorescenza. Il contenuto di alluminio del tessuto cerebrale nell’autismo è stato decisamente alto. La media (tra parentesi la deviazione standard) del contenuto di alluminio nei 5 individui per ogni lobo è stata 3,82(5,42), 2,30(2,00), 2,79(4,05) e 3,82(5,17) μg/g di peso della materia secca rispettivamente per il lobo occipitale, frontale, temporale e parietale. Questi sono tra i più alti valori di alluminio nel tessuto cerebrale umano misurati fino ad ora e bisogna chiedersi come mai, per esempio, il contenuto di alluminio del lobo occipitale di un ragazzo di 15 anni dovrebbe essere 8,74 (11,59) μg/g di peso della materia secca? La microscopia a fluorescenza selettiva per l’alluminio è stata utilizzata per identificare l’alluminio nel tessuto cerebrale di 10 donatori. Mentre si immaginava che l’alluminio fosse associato ai neuroni si è visto che è presente invece nella zona intracellulare in cellule simili alle microglia e in altre cellule infiammatorie non neuronali delle meningi, della vascolarizzazione, della materia grigia e della materia bianca. La preminenza dell’alluminio intracellulare associato con cellule non neuronali è stata una eccezionale osservazione nel tessuto cerebrale dei soggetti autistici e può offrire indizi sia riguardo all’origine dell’alluminio presente nel cervello che riguardo al possibile ruolo di tale sostanza nel causare il disturbo dello spettro autistico.
Introduzione
Il disturbo dello spettro autistico (Autism spectrum disorder - ASD) è un gruppo di condizioni patologiche dello sviluppo neurologico di causa ignota. È molto probabile che fattori sia genetici [1] che ambientali [2] siano associati con l’esordio e col progresso dell'ASD mentre ci si aspetta che i meccanismi sottostanti alla sua eziologia siano multifattoriali [3-6]. L’esposizione umana all’alluminio è stata sospettata di essere la causa dell’ASD ma le conclusioni sono state dubbie [7-10]. Fino ad ora la maggior parte degli studi hanno utilizzato il capello come indicatore dell’esposizione umana all’alluminio mentre il contenuto di alluminio nel sangue e nelle urine è stato utilizzato in misura molto più limitata. I vaccini pediatrici che includono un adiuvante a base di alluminio sono una misura indiretta dell’esposizione degli infanti all’alluminio e il loro crescente utilizzo è stato correlato direttamente all’aumento della prevalenza dell’ASD [11]. Modelli animali di ASD continuano a supportare una connessione con l’alluminio e gli adiuvanti a base di alluminio utilizzati particolarmente per le vaccinazioni umane [12]. Fino ad ora non ci sono studi sulla presenza di alluminio nel tessuto cerebrale di donatori che sono morti con una diagnosi di ASD. Abbiamo misurato la quantità di alluminio presente nel tessuto cerebrale di soggetti autistici e identificato la localizzazione dell’alluminio in questi tessuti.
Materiali e metodi
2.1. Misura delle quantità di alluminio nei tessuti cerebrali
L’approvazione etica è stata ottenuta assieme ai tessuti dalla “Banca del cervello di Oxford” (Oxford Brain Bank - 15/SC/0639). Campioni di corteccia pari a circa un grammo di materia congelata dei labi temporale, frontale, parietale e occipitale e dell’ippocampo (solo 0,3 gr) sono stati ottenuti da 5 individui con diagnosi di ASD confermata tramite ADI-Rconfirmed (Autism Diagnostic Interview-Revised), 4 maschi e 1 femmina, di età compresa tra 15 e 50 anni (Tabella 1). Il contenuto di alluminio di questi tessuti è stato misurato per mezzo di un metodo consolidato e pienamente validato [13] che qui viene descritto solo brevemente.
Risultati
3.1 Contenuto di alluminio nei tessuti cerebrali
Il contenuto di alluminio in tutti i tessuti variava da 0,01 (il limite per la quantificazione) a 22,11 mg/g di peso della materia secca. (Tabella 1). Il contenuto di alluminio per i cervelli nella loro interezza (n=4 o 5 a seconda della disponibilità del tessuto dell’ippocampo) variavano tra 1,20 (1,06) mg/g di materia secca per la donna di 44 anni (A1) ai 4,77 (4,79) mg/g del maschio di 33 anni (A5). Precedenti misurazioni dell’alluminio nel cervello, incluso il nostro studio di 60 cervelli [15], ci hanno permesso di definire approssimativamente della classi di contenuto di alluminio iniziando dai valori minori o uguali a 1,00 mg/g come patologicamente benigni (come opposto del concetto di ‘normale’). Approssimativamente il 40% dei tessuti (24/59) avevano un contenuto di alluminio considerato patologicamente preoccupante (³2,00 mg/) mentre il 67% circa di questi tessuti avevano un contenuto di alluminio considerato come patologicamente significante (³3,00 mg/g). Il cervello di tutti e 5 gli individui ha almeno un tessuto con un contenuto di alluminio patologicamente significante. I cervelli dei 4 individui avevano almeno un tessuto con un contenuto di alluminio maggiore o uguale a 5,00 mg/g, mentre 3 di questi avevano almeno un tessuto con un contenuto di alluminio maggiore o uguale a 10,00 mg/g (Tabella 1). Il contenuto medio di alluminio (deviazione standard tra parentesi) dei 5 individui per ogni lobo era rispettivamente 3,82(5,42), 2,30(2,00), 2,79(4,05) e 3,82(5,17) per i lobi frontali, occipitali, frontali, temporali e parietali. Non ci sono state differenze statisticamente significative nel contenuto di alluminio tra i 4 lobi.
3.2. Fluorescenze dovuta alluminio nei tessuti cerebrali
Abbiamo esaminato sezioni seriali del cervello di 10 individui (3 femmine e 7 maschi) che sono morti con una diagnosi di ASD e abbiamo registrato la presenza di alluminio in questi tessuti (Tabella S1). L’eccitazione del complesso di alluminio e lumogallion emette una caratteristica fluorescenza arancione che appare di un giallo sempre più brillante man mano che aumenta l’intensità della fluorescenza. L’alluminio, identificato come depositi reattivi al lumogallion, è stato registrato in almeno un tessuto in tutti e 10 gli individui. L’autofluorescenza delle sezioni seriali immediatamente adiacenti ha confermato che la fluorescenza del lumogallion è indicativa della presenza di alluminio. I depositi di alluminio erano significativamente più frequenti nei maschi (129 su 7 individui) che nelle femmine (21 su 3 individui). L’alluminio è stato trovato sia nella materia bianca (62 depositi) che nella materia grigia (88 depositi). Nelle femmine la maggior parte dei depositi di alluminio è stata identificata come extracellulare (15 su 21) mentre nei maschi è stata riscontrata la situazione opposta con 80 su 129 depositi nella zona intracellulare. Ci sono state fornite solo 3 sezioni seriali di ogni tessuto e quindi non siamo stati capaci di effettuare nessuna colorazione finalizzata all’identificazione della morfologia generale il che significa che non è sempre stato possibile determinare che sottotipo di cellula stesse mostrando la fluorescenza dovuta all’alluminio. Le cellule bianche del sangue mononucleari cariche di alluminio, probabilmente linfociti, sono state identificate nelle meningi e probabilmente stavano entrando nel tessuto cerebrale dal sistema linfatico (Fig. 10). L’alluminio potrebbe chiaramente essere visto all’interno delle cellule o sotto forma di depositi discreti puntuali, o come intense fluorescenze gialle (Fig. 1). L’alluminio è stato localizzato in cellule infiammatorie associate con la vascolarizzazione (Fig. 2). In un caso quello che sembra un linfocita o monocita carico di alluminio è stato notato dentro un vaso sanguigno circondato da globuli rossi mentre un altro probabile linfocita che mostrava un’intensa fluorescenza gialla è stato notato nella membrana avventizia (Fig. 2b). Le cellule gliali, incluse alcune simili a quelle della microglia che mostravano fluorescenza dovuta alla presenza di alluminio, sono state spesso osservate nel tessuto cerebrale in vicinanza dei depositi extracellulari colorati dall’alluminio (Figure 3 e 4). Depositi di alluminio approssimativamente di 1mm di diametro erano chiaramente visibili sia nei corpi rotondi che in quelli ameboidi delle cellule gliali (per es. Fig. 3b). L’alluminio intracellulare è stato identificato in probabili neuroni e in cellule simili a quelle della glia, e spesso nelle vicinanze o nello stesso sito della lipofuscina (Fig. 5). La fluorescenza selettiva per l’alluminio ha funzionato nell’identificazione dell’alluminio in siti extracellulari e intracellulari nelle cellule neuronali e non neuronali e in tutti i tessuti cerebrali studiati (Figure.1-5). Il metodo identifica l’alluminio solamente come evidenziato da larghe aree di tessuto cerebrale senza alcuna caratteristica fluorescenza che indica la positività all’alluminio (Fig. S1).
Discussione
Il contenuto di alluminio del tessuto cerebrale dei donatori con una diagnosi di ASD è stato estremamente alto (Tabella 1). Mentre si è rilevata una significativa variabilità tra i diversi tessuti, i diversi lobi, e i diversi soggetti, il contenuto medio di alluminio per ogni lobo (tra i 5 individui) si situava ai livelli più alti di tutte le precedenti misurazioni di contenuto di alluminio nel cervello, inclusi casi di disturbi iatrogeni come l’encefalopatia da dialisi [13,15, 16-19]. Tutti e 4 i donatori maschi avevano concentrazioni di alluminio nel cervello più alte dell’unica femmina donatrice. In questi maschi autistici abbiamo registrato alcuni dei più alti valori di contenuto di alluminio nel cervello mai misurati in tessuti sani o malati, inclusi valori di 17,10 18,57 e 22,11 mg/g di materia secca. (Tabella 1). Ciò che distingue questi dati da altre analisi di alluminio nel cervello in altre malattie, è l’età dei soggetti autistici. Perché, per esempio un ragazzino di 15 anni dovrebbe avere un contenuto di alluminio così alto nel suo tessuto cerebrale? Non ci sono dati paragonabili nella letteratura scientifica, il più vicino dato similmente alto è quello di un uomo di 42 anni con una “forma familiare” di morbo di Alzheimer (fAD) [19]. La microscopia a fluorescenza selettiva dell’alluminio ha fornito indicazioni sui siti di deposito dell’alluminio in questi tessuti cerebrali di soggetti autistici (Figure 1-5).
L’alluminio è stato trovato sia nella materia bianca che in quella grigia ed in siti sia extracellulari che cellulari. Questi ultimi erano particolarmente diffusi in questi tessuti di soggetti autistici. Cellule che morfologicamente apparivano non neuronali e pesantemente cariche di alluminio sono state identificate come cellule associate alle meningi (Fig. 1), alla vascolarizzazione (Fig. 2) e come cellule della materia grigia e della materia bianca (Figure. 3-5). Alcune di queste cellule apparivano gliali (probabilmente astrociti) mentre altre avevano nuclei elongati che davano loro l’apparenza di cellule della microglia [5]. Queste ultime sono state a volte viste nelle vicinanze dei depositi extracellulari di alluminio. Ciò implica che l’alluminio in qualche modo abbia attraversato la barriera emato-encefalica e sia stato preso da una cellula nativa, una cellula della microglia. Cosa interessante, la presenza occasionale di cellule infiammatorie cariche di alluminio nela vascolarizzazione e nelle leptomeningi apre la possibilità di un diverso modo di ingresso dell’alluminio nel cervello, ovvero per via intracellulare. Tuttavia, affinché tale secondo scenario possa essere valido ci si aspetterebbe che si verificasse qualche tipo di danno intracerebrale per permettere la fuoriuscita dei linfociti e dei monociti dalla vascolarizzazione. L’identificazione qui fatta di cellule non neuronali incluse le cellule infiammatorie, cellule gliali e cellule della microglia, tutte cariche di alluminio, è un’osservazione eccezionale per l’ASD. Per esempio, la maggior parte dei depositi di alluminio identificati nel tessuto cerebrale nelle “forme familiari” di morbo di Alzheimer erano extracellulari e quasi sempre associati con la materia grigia [19].
L’alluminio è citotossico [21] e la sua associazione (qui mostrata) con le cellule infiammatorie della vascolarizzazione, delle meningi e del sistema nervoso centrale difficilmente può essere benigna. La microglia pesantemente caricata di alluminio, mentre potrebbe restare vitale, almeno per qualche tempo, sarà inevitabilmente compromessa e si pensa che la disfunzione della microglia sia coinvolta nell’eziologia dell’ ASD [22], per esempio nel danneggiare la sfrondatura sinaptica [23]. In oltre il fatto che questi dati suggeriscano che l’entrata dell’alluminio nel cervello per mezzo delle cellule del sistema immunitario che circolano nel sangue e nella linfa sia accelerata nei soggetti autistici potrebbe iniziare a spiegare la questione posta prima sul motivo per il quale ci sia così tanto alluminio nel cervello di un ragazzo autistico di 15 anni. Una limitazione del nostro studio è il piccolo numero di casi disponibili per l’analisi e la limitata disponibilità di tessuto. Riguardo a quest’ultimo fattore, l’avere accesso a solo 1g di tessuto congelato e solo 3 sezioni seriali di tessuto fissato per ogni lobo potrebbe normalmente essere considerata una limitazione significativa. Certamente se non avessimo identificato nessun deposito significativo di alluminio in un così piccolo campione di tessuto (la massa media del cervello varia tra 1.500 e 2.000 gr) allora un simile risultato sarebbe equivoco. Tuttavia, il fatto che abbiamo trovato alluminio in ogni singolo campione di tessuto, congelato o fissato, suggerisce fortemente che gli individui con una diagnosi di ASD hanno livelli straordinariamente alti di alluminio nel tessuto cerebrale e che questo alluminio è preminentemente associato con cellule non neuronali incluse quelle della microglia e di altri monociti infiammatori.
Conclusioni
Abbiamo compiuto la prima misura del contenuto di alluminio nel tessuto cerebrale in soggetti autistici e abbiamo mostrato che il contenuto di alluminio nel cervello è straordinariamente alto. Abbiamo identificato l’alluminio nel tessuto cerebrale sia nella zona extracellulare che in quella intracellulare (sia nei neuroni che nelle cellule non neuronali). La presenza di alluminio nelle cellule infiammatorie nelle meningi, nella vascolarizzazione, nella materia grigia e bianca è una osservazione eccezionale e potrebbe dimostrare un ruolo causare dell’alluminio nell’eziologia dell’ ASD.
PSUR 16: raddoppiamento delle morti attese
Se tutti i bambini che hanno ricevuto la prima dose del vaccino ricevono in tutto quattro dosi e l'ultima dose è somministrata nel secondo anno di vita, allora si può stimare che un quarto (25%) delle dosi vengono somministrate a bambini di età superiore ad un anno. Questo è il programma vaccinale raccomandato in Germania. Tuttavia, alcuni paesi, come l'Italia, consigliano solo tre dosi, tutte nel primo anno e nessuna nel secondo. Inoltre, non tutti i bambini ricevono tutte le dosi raccomandate. Quindi è improbabile che il 20-25% delle dosi venga utilizzato nel secondo anno. Nel PSUR 15, è stato stimato che il 90,6% delle dosi vendute venisse utilizzato in neonati sotto l’anno di età e il 9,4% per quelli al di sopra di un anno di età. Nel PSUR 16, la stima delle dosi ricevute il secondo anno è più che raddoppiato (dal 9,4% al 20%), e quindi la stima delle morti attese è raddoppiata. Nonostante il raddoppiamento del le morti attese, il numero di morti osservate nel secondo anno era superiore a quello atteso nei primi 3 giorni dopo la vaccinazione (Tabella 36, p249). Se la stima nel PSUR 15 che il 9,4% delle dosi vengono utilizzate nel secondo anno è corretta, ciò vale anche per il PSUR 16, e quindi le morti osservate risultano superiori alle morti attese nei primi 7 giorni.
Conflitti di interesse di interesse
Gli autori dichiarano di non avere conflitti di interesse
Ringraziamenti
La ricerca è supportata da un finanziamento del Children’s Medical Safety Research Institute (CMSRI), una fondazione no-profit basata a Washington DC, USA, che si occupa di ricerca
Riferimenti
- A. Krishnan, R.Zhang, V. Yao, C.L.Theesfeld, A.K. Wong et al., Genome-wide prediction and functional characterisation of the genetic basis of autism spectrum disorder, Nature Neuroscience 19 (2016) 1454-1462.
- L.A. Sealey, B.W. Hughes, A.N. Sriskanda, J.R. Guest, A.D. Gibson et al., Environmental factors in the development of autism spectrum disorders, Environ. Int. 88 (2016) 288-298.
- R. Koyama, Y. Ikegaya, Microglia in the pathogenesis of autism spectrum disorders, Neurosci. Res. 100 (2015) 1-5.
- Q. Li, J-M. Zhou, The microbiota-gut-brain axis and its potential therapeutic role in autism spectrum disorder, Neuroscience 324 (2016) 131-139.
- C. Kaur, G. Rathnasamy, E-A. Ling, Biology of microglia in the developing brain, J. Neuropathol Exp. Neurol. 76 (2017) 736-753.
- M. Varghese, N. Keshav, S. Jacot-Descombes, T. Warda, B. Wicinski et al., Autism spectrum disorder: neuropathology and animal models, Acta Neuropathol. 134 (2017) 537- 566.
- H. Yasuda, Y. Yasuda, T. Tsutsui, Estimation of autistic children by metallomics analysis, Sci. Rep. 3 (2013) 1199.
- F.E.B. Mohamed, E.A. Zaky, A.B. El-Sayed, R.M. Elhossieny, S.S. Zahra et al., Assessment of hair aluminium, lead and mercury in a sample of autistic Egyptian children: environmental risk factors of heavy metals in autism, Behavioural Neurol. (2015) Art. 545674.
- M.H. Rahbar, M. Samms-Vaughn, M.R. Pitcher, J. Bressler, M. Hessabi et al., Role of metabolic genes in blood aluminium concentrations of Jamaican children with and without autism spectrum disorder, Int. J. Environ. Res. Public Health 13 (2016) 1095.
- A.V. Skalny, N.V. Simashkova, T.P. Klyushnik, A.R. Grabeklis, I.V. Radysh et al., Analysis of hair trace elements in children with autism spectrum disorders and communication disorders, Trace Elem. Med. Biol. 177 (2017) 215-223.
- L. Tomljenovic, C.A. Shaw, Do aluminium vaccine adjuvants contribute to the rising prevalence of autism?, J. Inorg. Biochem. 105 (2011) 1489-1499.
- C.A. Shaw, Y. Li, L. Tomljenovic, Administration of aluminium to neonatal mice in vaccine-relevant amounts is associated with adverse long term neurological outcomes, J. Inorg. Biochem. 128 (2013) 237-244
- E. House, M. Esiri, G. Forster, P. Ince, C. Exley, Aluminium, iron and copper in human brain tissues donated to the medical research council’s cognitive function and ageing study, Metallomics 4 (2012) 56-65.
- M. Mold, H. Eriksson, P. Siesjö, A. Darabi, E. Shardlow, C. Exley, Unequivocal identification of intracellular aluminium adjuvant in a monocytic THP-1 cell line, Sci. Rep. 4 (2014) 6287.
- A. Mirza, A. King, C. Troakes, C. Exley, The identification of aluminium in human brain tissue using lumogallion and fluorescence microscopy, J. Alzh. Dis. 54 (2016) 1333-1338.
- C. Exley, M. Esiri, Severe cerebral congophilic angiopathy coincident with increased brain aluminium in a resident of Camelford, Cornwall, UK, J. Neurol. Neurosurg. Psychiatry 77 (2006) 877-879.
- C. Exley, E.R. House, Aluminium in the human brain, Monatsh. Chem. 142 (2011) 357- 363.
- C. Exley, T. Vickers, Elevated brain aluminium and early onset Alzheimer’s disease in an individual occupationally exposed to aluminium: a case report, J. Med. Case Rep. 8 (2014) 41.
- A. Mirza, A. King, C. Troakes, C. Exley, Aluminium in brain tissue in familial Alzheimer’s disease, J. Trace Elem. Med. Biol. 40 (2017) 30-36.
- R. Shechter, O. Miller, G. Yovel, N. Rosenzweig, A. London et al., Recruitment of beneficial M2 macrophages to injured spinal cord is orchestrated by remote brain choroid plexus, Immunity 38 (2013) 555-569.
- C. Exley, The toxicity of aluminium in humans, Morphologie 100 (2016) 51-55.
- M.W. Salter, B. Stevens, Microglia emerge as central players in brain disease, Nat. Med. 23 (2017) 1018-1027.
- U. Neniskyte, C.T. Gross, Errant gardeners: glial-cell-dependent synaptic pruning and neurodevelopmental disorders, Nat. Rev. Neurosci. 18 (2017) 658-670.
- An alternative approach to combination vaccines: intradermal administration of isolated components for control of anthrax, botulism, plague and staphylococcal toxic shock (pubblicato su Journal of Immune Based Therapies and Vaccines. 2008 Sep 3;6:5; autori Morefield GL, Tammariello RF et al; https://www.ncbi.nlm.nih.gov/pubmed/18768085/)
Figura1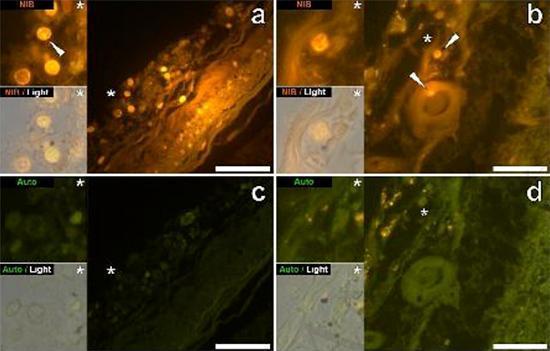
Figura2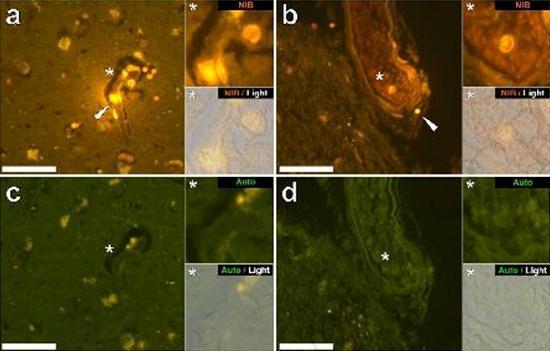
Figura3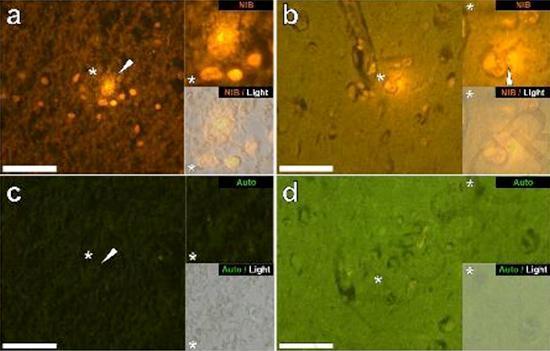
Figura4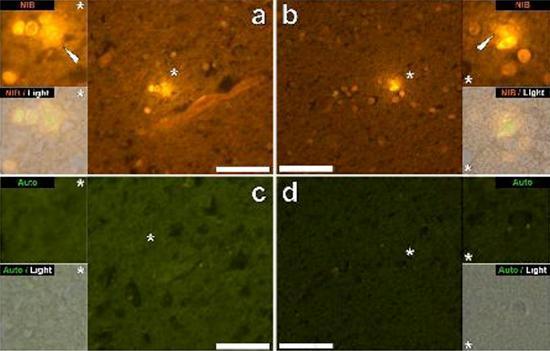
Figura5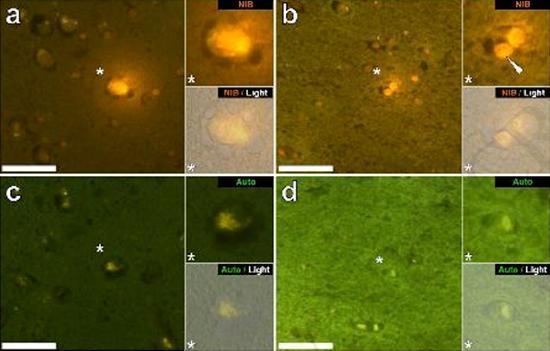
Fonte: Aluminium in brain tissue in autism
Download: Aluminium in brain tissue in autism

