Der Bericht, der die Verschleierung der Todesfälle von Säuglingen nach der Impfung hervorhebt

Zwei Ärzte in Neu-Delhi berichteten von einem Versuch eines multinationalen Arzneimittelherstellers, plötzliche Todesfälle bei Neugeborenen nach Verabreichung des Impfstoffs zu verbergen. Jacob Puliyel, ein Kinderarzt im Santo Stefano-Krankenhaus, und C. Sathyamala, ein Epidemiologe, berichteten über ihre Entdeckung im Peer-Review-Indian Journal of Medical Ethics.
Der fragliche Impfstoff "Infanrix hexa", der Impfstoffe gegen Diphtherie, Tetanus, Pertussis, Hepatitis B, Kinderlähmung und Typ B-Grippe kombiniert, wird von GlaxoSmithKline (GSK) hergestellt und wurde im Oktober 2000 in Europa eingeführt.
Puliyel und Sathyamala entdeckten die Geheimhaltung, indem sie die Daten in den regelmäßigen Sicherheitsaktualisierungsberichten (PSUR) in Bezug auf den Impfstoff analysierten, die sein Hersteller GSK der Europäischen Arzneimittelagentur (EMA) regelmäßig vorlegen muss.
Diese vertraulichen Sicherheitsberichte zu diesem Impfstoff gingen bei Puliyel von einem italienischen Forscher ein, der sie von der EMA gemäß dem Freedom of Information Act - der italienischen Version des Rechts auf Information in Indien - erhalten hatte.
Laut der Analyse stellten die Ärzte fest, dass der neueste Impfstoff-Sicherheitsbericht von "Infanrix hexa" von GSK (2015) hat den Tod abgesagt zuvor vom Hersteller in seinem 16. Bericht (2012) berichtet. Sie stellen jedoch fest, dass im Bericht nicht klar ist, wie diese Todesfälle abgesagt wurden.
Die Autoren Puliyel und Sathyamala stellen fest, dass einer der Autoren, William Thompson, zehn Jahre nach der Veröffentlichung eines Artikels des Center for Disease Control (CDC), in dem die Beziehung zwischen MMR und Autismus untersucht wurde, zugab, dass er und seine Mitautoren Informationen ausgelassen hatten. statistisch signifikant - d. h., dass afroamerikanische Männer, denen der MMR-Impfstoff vor dem Alter von 36 Monaten verabreicht worden war, einem erhöhten Risiko für Autismus ausgesetzt waren. Nachdem Thompson und seine Kollegen Hinweise auf dieses erhöhte Risiko gefunden hatten, löschten sie Daten von Kindern ohne georgische Geburtsurkunde (und disqualifizierten daher eine unverhältnismäßig große Anzahl schwarzer Kinder) und präsentierten ihre Daten mit der Begründung, dass es keine gäbe erhöhtes Risiko für Autismus. Es ist unklar, ob die Autoren von PSUR 19 eine ähnliche rückwirkende Disqualifikation der Kinder durchgeführt haben, von denen dokumentiert ist, dass sie in PSUR 16 gestorben sind.
"Wenn diese Todesfälle nicht geklärt worden wären, wären die Todesfälle nach der Impfung wesentlich höher ausgefallen als zufällig angenommen. Der Hersteller hätte der EMA eingestehen müssen, dass sein Impfstoff die Ursache für diese übermäßigen Todesfälle war."
Puliyel und Sathyamala behaupten, der Hersteller müsse die scheinbar fehlerhaften Zahlen erklären, die er den Aufsichtsbehörden vorgelegt habe.
Bisher hat der Hersteller behauptet, dass die nach der Impfung gemeldeten Todesfälle "zusammenfallen" und dass sie bei diesen Kindern stattgefunden hätten, selbst wenn sie keine Impfungen erhalten hätten.
In ihrem Tagebuchkommentar weisen Puliyel und Sathyamala jedoch darauf hin, dass ihre Analyse ergab, dass 83% der gemeldeten Todesfälle unmittelbar nach der Impfung in den ersten 10 Tagen auftraten und nur 17% in den folgenden XNUMX Tagen.
"Wenn es sich um zufällige Todesfälle handelte, hätten sich nicht alle unmittelbar nach der Impfung angesammelt, sondern wären über den Zeitraum von 20 Tagen gleichmäßig verteilt worden."
Puliyel und Sathyamala schreiben, dass jedes Argument, das behauptet, dass plötzliche Todesfälle nach der Impfung durch durch den Impfstoff gerettete Leben ausgeglichen werden, nicht akzeptabel ist, genauso wie es als illegal angesehen würde, eine Person zu töten, um mit ihren Organen fünf weitere Menschen zu retten. .
"Das Verstecken von Todesfällen nach der Impfung kann die Bewertung des Sicherheitsprofils des Impfstoffs verhindern oder verzögern, und dies kann zu unnötigen und ethisch gerechtfertigten Todesfällen führen.
Die Autoren weisen darauf hin, dass Hexavac - ein ähnlicher Impfstoff, der von Sanofi Pasteur hergestellt und im Jahr 2000 auf den Markt gebracht wurde - 2005 vom europäischen Markt genommen wurde. Es wurde festgestellt, dass der Tod von Kindern innerhalb von zwei Tagen nach der Impfung zunahm.
Im indischen Kontext weisen die Autoren darauf hin, dass der Drug Controller General of India (DCGI) die derzeitige Richtlinie für die automatische Zulassung aller in den USA und in Europa zugelassenen Medikamente überdenken sollte. "Dieses Vertrauen, das auf der Sorgfaltspflicht der EMA beruht, kann falsch sein und muss überprüft werden."
"Pentavac", das vom Serum Institute of India hergestellt und in Indien vermarktet wird, ähnelt dem jetzt eingestellten Impfstoff gegen Hexavac und Infanrix Hexa, mit dem Unterschied, dass der Pertussis-Impfstoff für die gesamte Zelle durch einen azellulären Impfstoff ersetzt wurde und über einen Impfstoff gegen Hexavac verfügt eine sechste Komponente, der injizierbare Polio-Impfstoff. "
In Anbetracht ihres Feedbacks schlagen Puliyel und Sathyamala vor, dass "es unbedingt erforderlich ist, dass DCGI die PSUR-Berichte an die EMA und die in diesem Kommentar geäußerten Bedenken zur Kenntnis nimmt."
Die Studium
Indian Journal of Medical Ethics Online Erstveröffentlichung 5. September 2017
Infanrix hexa und plötzlicher Tod: Überprüfung der Aktualisierung der der Europäischen Arzneimittel-Agentur vorgelegten regelmäßigen Sicherheitsberichte
JACOB PULIYEL, C. SATHYAMALA
Autoren: Jacob Puliyel (korrespondierender Autor -
Anzuführen sind: Puliyel J, Sathyamala C. Infanrix hexa und plötzlicher Tod: eine Überprüfung der der Europäischen Arzneimittel-Agentur vorgelegten Berichte über regelmäßige Sicherheitsupdates. Indische J Med Ethik. Online veröffentlicht am 5. September 2017. Korrigiert am 9. September 2017 *. DOI: 10.20529 / IJME.2017.079
Herausgeber des Manuskripts: Mala Ramanathan © Indisches Journal für medizinische Ethik 2017
Abstrakt
Es gab mehrere spontane Berichte über unerwartete plötzliche Todesfälle unmittelbar nach der Verabreichung von Infanrix hexa (kombinierter Diphtherie-, Tetanus-, Pertussis-Impfstoff, inaktivierte Poliomyelitis, Hepatitis B und Haemophilus influenzae Typ B). Der Hersteller GlaxoSmithKline (GSK) übermittelt der Europäischen Arzneimittel-Agentur (EMA) regelmäßig vertrauliche Sicherheitsaktualisierungsberichte (PSURs) zu Infanrix Hexa. Die letzte ist PSUR * 19. Jede PSUR enthält eine Analyse der beobachteten / erwarteten plötzlichen Todesfälle, die zeigt, dass die Zahl der unmittelbar nach der Immunisierung beobachteten Todesfälle weniger als zufällig erwartet ist.
Dieser Kommentar konzentriert sich auf den Aspekt des PSUR, der politische Entscheidungen beeinflusst. Wir haben die im PSUR bereitgestellten Daten analysiert. Es ist offensichtlich, dass die in PSUR 16 festgestellten Todesfälle durch PSUR 19 beseitigt wurden. Die Zahl der Todesfälle, die unmittelbar nach der Impfung bei Kindern über einem Jahr beobachtet wurden, war signifikant höher als zufällig erwartet, wenn die Todesfälle geklärt waren restauriert und in die Analyse einbezogen.
Der Hersteller muss die den Aufsichtsbehörden vorgelegten Zahlen erläutern. Die von der EMA durchgeführten Verfahren zur Bewertung der Herstellerwarnungen im PSUR müssen überprüft werden. Der Medicines Controller General of India akzeptiert fast automatisch von der EMA zugelassene Medikamente und Impfstoffe. Die EMA muss das Vertrauen in die Sorgfalt überprüfen.
Einführung
Am 23. Oktober 2000 erfolgte die Vermarktung von zwei sechswertigen Impfstoffen, Infanrix hexa® (GlaxoSmithKline plc-GSK) und Hexavac® (Sanofi Pasteur MSD, SNC), die Diphtherie, Tetanus, azelluläre Pertussis, Hepatitis B, la Inaktivierte Poliomyelitis und Influenza Haemophilus Typ B wurde in der Europäischen Union zugelassen. Nach der Zulassung gab es mehrere spontane Berichte über einen unerwarteten plötzlichen Tod unmittelbar nach der Verabreichung dieser sechswertigen Impfstoffe. 2005 führten von Kries und Kollegen (1) eine detaillierte Analyse durch, in der sie die unmittelbar nach der Impfung festgestellten Todesfälle mit den zu erwartenden Opfern verglichen. Sie fanden heraus, dass die standardisierte Mortalitätsrate (SMR) innerhalb von zwei Tagen nach der Hexavac-Impfung bei Kindern, die im zweiten Lebensjahr geimpft wurden, signifikant angestiegen war.
Dies war bei Infanrix Hexa nicht der Fall. Auf Antrag des Inhabers der Genehmigung für das Inverkehrbringen wurde Hexavac im Jahr 2005 zurückgezogen, und Infanrix Hexa wurde weiterhin in Europa vermarktet (2). Nach europäischem Recht ist die Europäische Arzneimittel-Agentur (EMA) für den Schutz der öffentlichen Gesundheit durch die Bewertung von Arzneimitteln verantwortlich, die von ihr als Regulierungsbehörden zugelassen wurden. Die Hersteller sind für die Wirksamkeit, Qualität und Sicherheit ihrer Arzneimittel verantwortlich (3).
Das italienische Gericht Nicola Di Leo hat der Öffentlichkeit die regelmäßigen vertraulichen Sicherheitsaktualisierungsberichte (PSUR) 15 und 16a von 2009 bis 2011 von GlaxoSmithKline (4) zur Verfügung gestellt. Der PSUR 19 (der den PSUR 17, 18 und 19 vom 15. Januar 2015 enthält) wurde von einem italienischen Forscher von der EMA gemäß Artikel 3 der EMA-Bestimmungen (EMA 110196/2006 vom 30. November 2010) beschafft (5) ). Der italienische Arzt sandte diese PSUR an den Erstautor (JP) und bat ihn, einen Bericht zu verfassen, der dem Europäischen Parlament vorgelegt werden soll. Dieser Kommentar basiert auf all diesen PSURs. Im Zusammenhang mit dem zuvor von Kries (1) hervorgehobenen Sicherheitsaspekt wird in diesem Kommentar der plötzliche Tod nach der Anwendung des Impfstoffs Infanrix Hexa untersucht. Andere im PSUR behandelte Aspekte werden nicht untersucht.
PSUR 15 - Gruppierung der Toten nach der Impfung
Die meisten Todesfälle, die nach dem Neugeborenen auftreten, sind auf Infektionen, Geburtsfehler, bösartige Erkrankungen oder Unfälle zurückzuführen. Kinder sterben selten ohne offensichtliche Ursache, weshalb Todesfälle als (i) plötzliches Todessyndrom (SIDS) klassifiziert werden, das im PSUR als Tod definiert wird, der im ersten Lebensjahr auftritt und nach der Autopsie unerklärt bleibt, oder (ii ) Unerwarteter plötzlicher Tod (SOUTH), definiert als der Tod innerhalb der ersten zwei Lebensjahre, der nach klinischer und endgültiger Vorgeschichte der Ereignisse ungeklärt bleibt, jedoch ohne Autopsie. Zusammengenommen werden diese beiden in PSUR 15 als plötzlicher Tod (SD) angesehen. Eine bestimmte Anzahl von Impfstoffen wird an einem bestimmten Tag an Kinder unter 2 Jahren verabreicht, und die Anzahl der weltweit geimpften Kinder ist sehr hoch. Es ist möglich, dass einige geimpfte Kinder zufällig an SIDS / SUD sterben. Solche Ereignisse wären auch dann aufgetreten, wenn diese Kinder an diesem Tag nicht geimpft worden wären. Um festzustellen, ob ein solcher Tod durch Impfung verursacht wurde oder ein zufälliges Ereignis war, wird eine beobachtete / erwartete SD-Analyse durchgeführt. Die Analyse beurteilt, ob die Anzahl der nach der Impfung festgestellten Todesfälle die zufälligen Vorhersagen übersteigt.
Plötzliche Todesfälle: Entgegen den Erwartungen beobachtet
PSUR 15 erklärt, wie diese Analyse durchgeführt wurde (4: S. 782): "Die Gesellschaft bewertete, ob die Anzahl der in dieser Altersgruppe gemeldeten plötzlichen Todesfälle, die die Nummer eins überschritt, zufällig auftreten konnte. Seit der Altersverteilung Wo die Probanden geimpft wurden, ist unbekannt, das Unternehmen ging davon aus, dass der Anteil der unerwünschten Ereignisse nach Alter repräsentativ für die tatsächliche Altersverteilung bei der Impfung ist. Es kann daher geschätzt werden, dass 90,6% aller Infanrix-Empfänger Hexa befanden sich in ihrem ersten Lebensjahr und 9,4% im zweiten Lebensjahr. Daher wurde die Anzahl der Dosen (seit dem Start) auf 54.927.729 bzw. 5,698,904 geschätzt, da Deutschland das ist In dem Hauptland, in dem Infanrix Hexa-Dosen verteilt werden (fast 30% allein in Deutschland), wurde angenommen, dass die in Deutschland beobachtete Häufigkeit plötzlicher Todesfälle repräsentativ für die gesamte Empfängerpopulation von Infanrix Hexa (Bundesamt) istDeutsche Statistik, Statistisches Bundesamt; Inzidenzrate im ersten Lebensjahr: 0,454 / 1000 Lebendgeburten; zweites Jahr: 0.062 / 1000 Lebendgeburten, Daten 2008).
Der PSUR dokumentiert den gemeldeten Tod innerhalb von 20 Tagen nach der Impfung. Die beobachtete Zahl der Todesfälle war geringer als erwartet (Tabelle 1).
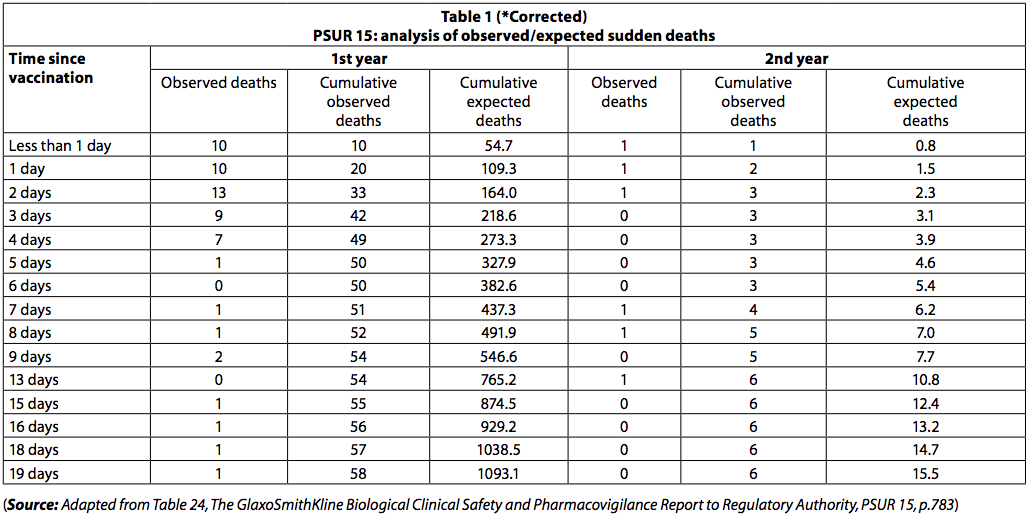
Bei Neugeborenen gab es jedoch unmittelbar nach der Impfung eine Häufung von Todesfällen, wobei 42 Todesfälle in den ersten drei Tagen nach der Impfung und nur 8 in den nächsten drei Tagen auftraten. Unter den weniger als einem Jahr traten 3 Todesfälle (54%) in den ersten zehn Tagen und 93 (4%) in den folgenden 7 Tagen auf. Wenn die Todesfälle "zufällige SIDS-Todesfälle" gewesen wären, wäre diese Ungleichheit in der Anzahl der Todesfälle über die beiden Zeiträume nicht beobachtet worden.
Todesfälle durch SIDS wären gleichmäßig über den Zeitraum von 20 Tagen verteilt gewesen.
Die Tatsache, dass die Sterblichkeitsrate im Laufe der Zeit nach der Immunisierung rapide abnimmt, legt nahe, dass die Todesfälle mit der Impfung zusammenhängen können.
In ähnlicher Weise traten bei Kindern über einem Jahr in den ersten 5 Tagen 83,3 Todesfälle (10%) und in den folgenden 17 Tagen ein Todesfall (10%) auf. Die in PSUR 15 gemeldete Gruppierung der Todesfälle wurde auch in PSUR 16 vermerkt, und dies wurde bereits früher kommentiert (6).
Die Antwort von GlaxoSmithKline
Als Reaktion auf diese Kritik (7) schlug Sir Andrew Witty, Chief Executive Officer (CEO) von GlaxoSmithKline (GSK), in einem Brief durch Dr. Norman Begg, den Chief Medical Officer des Unternehmens, vor, dass dies viel wahrscheinlicher sei über einen möglichen Kausalzusammenhang nachzudenken und dann ein unerwünschtes Ereignis an GSK zu melden, wenn es kurz nach der Impfung und nicht Wochen später auftritt. Er schrieb weiter: "In Anbetracht des oben Gesagten bleiben wir zuversichtlich in den Schlussfolgerungen, die GSK zuvor gezogen und mit Aufsichtsbehörden und Gesundheitsbehörden auf der ganzen Welt geteilt hat, dass die derzeit verfügbaren Daten kein erhöhtes Risiko für einen plötzlichen Kindstod nach sich ziehen Impfung mit Infanrix hexa. Sollten sich die verfügbaren Daten und Informationen ändern und auf ein erhöhtes Risiko hinweisen, sind wir weiterhin verpflichtet, die Behörden unverzüglich zu benachrichtigen und die erforderlichen Maßnahmen zu ergreifen, um diese Daten und Informationen den Angehörigen der Gesundheitsberufe mitzuteilen. "
In dieser Antwort wird stillschweigend eingeräumt, dass während des Zeitraums nach der Impfung keine aktive Wachsamkeit bestand und nur spontan bei GSK gemeldete Todesfälle unter der Überschrift "beobachtete Todesfälle" aufgeführt wurden. Dies könnte zu einer Unterschätzung der Todesfälle nach der Impfung führen. Es ist zu beachten, dass die Anzahl der verteilten Impfstoffdosen für "erwartete Todesfälle" verwendet wird. In dem Bericht wird anerkannt, dass nicht unbedingt alle Dosen des verteilten Impfstoffs verwendet wurden. Auf diese Weise wurde die Zahl der "erwarteten Todesfälle" erhöht.
Angesichts der Erklärung und Zusicherung des CEO, dass sich GSK verpflichtet hat, die Behörden und Angehörigen der Gesundheitsberufe unverzüglich über ein erhöhtes Risiko für Infanrix Hexa zu informieren, wurde das Problem der Gruppierung von Todesfällen nicht weiter untersucht.
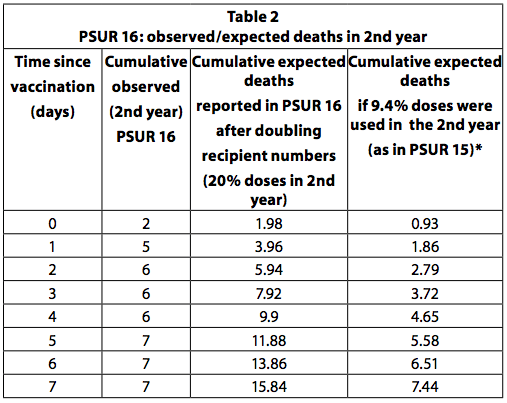
PSUR 16: Verdoppelung der erwarteten Todesfälle
Wenn alle Kinder, die die erste Dosis des Impfstoffs erhalten haben, insgesamt vier Dosen erhalten und die letzte Dosis im zweiten Lebensjahr verabreicht wird, kann geschätzt werden, dass ein Viertel (25%) der Dosen älteren Kindern verabreicht wird zu einem Jahr. Dies ist der empfohlene Impfplan in Deutschland. Einige Länder, wie Italien, empfehlen jedoch nur drei Dosen, alle im ersten Jahr und keine im zweiten. Darüber hinaus erhalten nicht alle Kinder alle empfohlenen Dosen. Daher ist es unwahrscheinlich, dass 20-25% der Dosen im zweiten Jahr angewendet werden. In PSUR 15 wurde geschätzt, dass 90,6% der verkauften Dosen bei Säuglingen unter einem Jahr und 9,4% bei Säuglingen über einem Jahr angewendet wurden. In PSUR 16 hat sich die Schätzung der im zweiten Jahr erhaltenen Dosen mehr als verdoppelt (von 9,4% auf 20%), und daher hat sich die Schätzung der erwarteten Todesfälle verdoppelt. Trotz der Verdoppelung der erwarteten Todesfälle war die Zahl der im zweiten Jahr beobachteten Todesfälle in den ersten drei Tagen nach der Impfung höher als erwartet (Tabelle 3, S. 36). Wenn die Schätzung in PSUR 249, dass 15% der Dosen im zweiten Jahr verwendet werden, richtig ist, gilt dies auch für PSUR 9,4, und daher sind die beobachteten Todesfälle höher als die erwarteten Todesfälle in den ersten 16 Tagen.
PSUR 19: Voraussichtliche Todesfälle, gewichtet nach Land und jährlichem Dosisanteil
In PSUR 19 wurde ein kalendergewichteter Durchschnitt der Inzidenzraten plötzlicher Todesfälle aus Deutschland, Frankreich und den Niederlanden berechnet, um die erwartete Inzidenz plötzlicher Todesfälle zu ermitteln.
In sehr einfachen Worten bedeutet dies, dass, wenn 60% der Dosen in einem bestimmten Jahr in Deutschland verteilt wurden, die SD-Rate (Sudden Death) in Deutschland bei der Berechnung der SD-Rate mit 60% gewichtet wurde. insgesamt für dieses Jahr; Wenn 30% in Frankreich vertrieben wurden, trug der SD-Satz in Frankreich 30% bei, und der niederländische SD-Satz wurde mit 10% gewichtet. Schließlich wurde die globale SD-Rate für alle Jahre zusammen berechnet.
Die SD-Gesamtrate wurde für das zweite Jahr mit 0.0102 / 1000 Lebendgeburten berechnet. Diese Zahl ist ein Sechstel der erwarteten Häufigkeit, die in PSUR 15 und 16 verwendet wurde (wobei nach deutschen Daten plötzliche Todesfälle bei 0,062 / 1000 Lebendgeburten berechnet wurden).
Das Poisson-Konfidenzintervall (CI) von 95% der im zweiten Jahr beobachteten Todesfälle ist in Tabelle 8 ap 447 des PSUR 19 angegeben. Es wird berichtet, dass die Anzahl der im zweiten Lebensjahr beobachteten Todesfälle ebenfalls höher war wenn nicht signifikant, dann den erwarteten Todesfall innerhalb eines Risikozeitraums von 1-4 Tagen nach der Impfung.
Fehlende Todesfälle in PSUR 19
Von PSUR 16 auf PSUR 19 stiegen die Gesamtimpfstoffdosen von 69 auf 112 Millionen. Nach PSUR 19 wurde angenommen, dass 20,2% der verteilten Dosen im zweiten Lebensjahr an Kinder verabreicht wurden (PSUR 19, S. 436-448). Todesfälle, bei denen das Impfalter nicht bekannt war, das Todesdatum nicht erfasst wurde oder der Zeitpunkt des Todes 19 Tage nach der Impfung überschritt, wurden ausgeschlossen.
In der PSUR 19 (Todesfälle bis zum 22. Oktober 2014) werden die in der PSUR 16 (Todesfälle bis zum 22. Oktober 2011) genannten plötzlichen Todesfälle nicht gemeldet. Es ist zu beachten, dass in PSUR 16 sowohl das Alter des nach der Impfung verstorbenen Kindes als auch der Zeitpunkt des Todes (innerhalb von 14 Tagen nach der Impfung) erfasst wurden.
Die kumulierten Todesfälle sind in PSUR 19 niedriger als in PSUR 16. Bei Kindern über einem Jahr werden in PSUR 19 nur 5 Todesfälle in den ersten 19 Tagen nach der Impfung verzeichnet, in PSUR 16 8 Die Zahlen stimmen nicht überein. Wir fragen uns, warum das so ist.
Zehn Jahre nach der Veröffentlichung des CDC-Artikels (Center for Disease Control), in dem die Beziehung zwischen dem Impfstoff gegen Masern, Mumps und Röteln (MMR) und Autismus untersucht wurde (8), gab einer der Autoren, William Thompson, dies zu Er und seine Co-Autoren zeigten keine statistisch signifikanten Informationen darüber, dass afroamerikanische Männer, die vor dem Alter von 36 Monaten MMR erhielten, ein erhöhtes Risiko für Autismus hatten (9). Die Autoren löschten die Daten der Kinder, die in Georgien keine Geburtsurkunde hatten (10), um eine unverhältnismäßig große Anzahl schwarzer Kinder auszuschließen, und legten ihre Daten vor, um zu zeigen, dass es keine Zunahme der Kinder gegeben hatte Risiko.
Es ist unklar, ob die Autoren von PSUR 19 in ähnlicher Weise tote und dokumentierte Kinder in PSUR 16 ausgeschlossen haben.
In Tabelle 3 sind die in PSUR 19 gemeldeten beobachteten und erwarteten Todesfälle sowie die nach der Wiederherstellung der in PSUR 16 gemeldeten Todesfälle beobachteten Todesfälle aufgeführt.
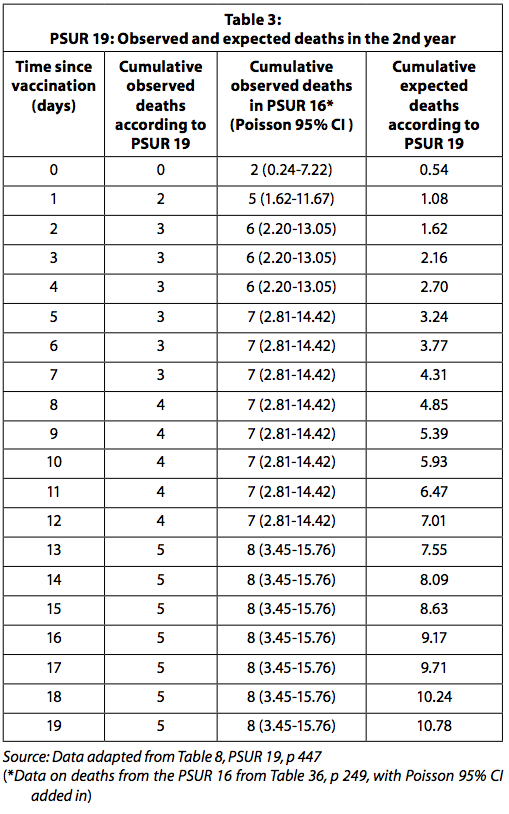
Wenn die Daten zu beobachteten Todesfällen in PSUR 16 verwendet werden, ist die Anzahl der beobachteten Todesfälle in den ersten vier Tagen nach der Impfung signifikant höher als erwartet. Wie oben erläutert, muss berücksichtigt werden, dass die Anzahl der beobachteten Todesfälle, die passiv erfasst werden, wahrscheinlich unterschätzt wird. Die erwarteten Todesfälle werden wahrscheinlich überschätzt, da sie unter der Annahme berechnet werden, dass alle verteilten Dosen ohne Verlust angewendet wurden und kein Impfstoff verworfen wurde, weil er abgelaufen ist. Es wurde erwartet, dass GSK das statistisch signifikant erhöhte Sterberisiko in den vier Tagen nach der Impfung der Aufsichtsbehörde und den Ärzten meldet.
Die verwendeten Dosen im zweiten Jahr
PSUR 19 geht davon aus, dass 20,2% der Dosen im zweiten Jahr angewendet wurden. Darin heißt es, dass die Verteilung des Alters, in dem die Probanden geimpft wurden, unbekannt ist, und das Unternehmen hat spekuliert, dass der Anteil der unerwünschten Ereignisse (einschließlich des Todes) nach Alter für die tatsächliche Altersverteilung bei der Impfung repräsentativ ist. Da 20,2% der unerwünschten Ereignisse bei Kindern über einem Jahr auftraten, ging das Unternehmen davon aus, dass 20,2% der Dosen für diese Altersgruppe angewendet wurden.
Anhand der beobachteten unerwünschten Ereignisse (einschließlich des Todes) kann die Anzahl der im zweiten Jahr verabreichten Dosen leicht abgeschätzt werden. Anschließend kann anhand dieser Dosisschätzung die erwartete Anzahl der Todesfälle berechnet und schließlich mit der beobachteten Anzahl der Todesfälle verglichen werden Die Schätzung des erwarteten Todes wird hauptsächlich aus den beobachteten negativen Ereignissen (einschließlich des Todes) berechnet.
Unter der Annahme, dass alle Todesfälle nach der Impfung koinzident und nicht kausal mit dem Impfstoff zusammenhängend sind, und unter der Annahme, dass (gemäß PSUR 19) die natürliche Häufigkeit des plötzlichen Todes im ersten Jahr 44-mal höher ist als im zweiten Jahr (0.441) / 1000 im ersten Jahr und 0.0102 / 1000 im zweiten Jahr) sollten 44-mal mehr Kinder im zweiten Jahr geimpft werden, um die gleiche Anzahl von Todesfällen wie im ersten Jahr zu erreichen.
In einer Kohorte von 100 Todesfällen müssen, wenn 20% der plötzlichen Todesfälle im zweiten Jahr und 80% im ersten Jahr auftreten, 880 Kinder im zweiten Jahr geimpft werden, je 20 Kinder im ersten Jahr geimpft wurden. In diesem Fall würde davon ausgegangen, dass 44% aller Infanrix hexa-Dosen im zweiten Jahr und nur 80% im ersten Jahr (statt umgekehrt) angewendet worden wären. Dies spiegelt die Absurdität der Berechnung der Dosisverteilung nach Alter wider, basierend auf der Altersverteilung von unerwünschten Ereignissen, wie im GSK-Dokument ausgeführt.
Die einzige Möglichkeit, die Anzahl der im zweiten Jahr verwendeten Dosen zu bewerten, besteht darin, Impfprogramme in verschiedenen Ländern zu untersuchen. Dabei ist zu prüfen, in welchen Ländern die vierte Dosis im zweiten Jahr empfohlen wird und in welchen Ländern die Dosen im zweiten Jahr nicht empfohlen werden. Für die Anzahl der in diesen Ländern verteilten Dosen kann ein Gewicht zugewiesen werden. Die Abbrecherquote (Kinder, die das Impfprogramm nach Erhalt der ersten Impfdosis verlassen) sollte bei der endgültigen Berechnung des Prozentsatzes der im zweiten Jahr verwendeten Dosen ebenfalls berücksichtigt werden. Es scheint, dass eine vernünftige Schätzung der im zweiten Jahr verwendeten Dosen 9,4% der Gesamtdosen beträgt, und dies ist die im PSUR 15 verwendete Zahl.
Das ethische Dilemma - das Wagenproblem
Dieser Kommentar versucht nicht zu untersuchen, ob diese übermäßigen Todesfälle nach der Impfung (vermutlich durch den Impfstoff verursacht) durch die durch die Krankheit geretteten Leben durch die mit dem Impfstoff erzielte Prävention kompensiert werden können. In seinem klassischen mentalen Experiment, dem so genannten Trolley-Dilemma, fragt Philippa Foot, ob es ethisch vertretbar ist, einen Trolley umzuleiten, der von einer Eisenbahnstrecke entkommen ist, an der fünf Menschen auf einer anderen Strecke getötet worden wären, auf der nur einer gestorben wäre (11). . In einer Variante des Karren-Dilemmas ist die einzelne Person auf der alternativen Spur das Kind der Person, die die Spuren wechseln kann.[2] Judith Thomson geht davon aus, dass Organtransplantationen von einem gesunden Spender fünf Leben retten können, und fragt, ob es ethisch vertretbar ist, eine Person absichtlich zu töten, um die anderen fünf zu retten (12). Ethik argumentiert, dass der Zweck die Mittel nicht rechtfertigen kann. Wenn Sie den Tod nach der Impfung verbergen, können Sie die Bewertung des Sicherheitsprofils des Impfstoffs verhindern / verzögern. Dies kann zu unnötigeren Todesfällen führen, die ethisch schwer zu rechtfertigen sind.
Relevanz für Indien
Die Regulierungsbehörde der indischen Regierung ist der Drug Controller General of India (DCGI). Nach den DCGI-Vorschriften sind Arzneimittel, die in einem oder mehreren Ländern wie den Vereinigten Staaten, dem Vereinigten Königreich, Kanada, Japan, Australien und der Europäischen Union zugelassen sind, auch in Indien zugelassen (13). Es sind nur zusätzliche Studien erforderlich, um die Auswirkungen ethnischer Faktoren auf die Wirksamkeit, Sicherheit, Dosierung und das Dosierungsschema von Arzneimitteln zu bewerten (14).
Kürzlich wurden in Indien Studien veröffentlicht, die die Immunogenität und Sicherheit des sechswertigen Kombinationsimpfstoffs in kleinen Studien untersuchen (15,16, 17). Darüber hinaus veröffentlichte Indian Pediatrics einen Leitartikel mit dem Titel "Sechswertige Impfungen: Die Zukunft der routinemäßigen Immunisierung?" (XNUMX), der vorschlug, diesen Kombinationsimpfstoff in Indien zu fördern. Es ist wichtig, dass die Regulierungsbehörde in Indien sich der Bedenken bewusst ist, die in diesem Kommentar zu den PSUR-Berichten geäußert werden, insbesondere da die Überwachungssysteme in Indien schwach sind.
Zusammenfassung und Fazit
Von Kries (1) berichtete über einen statistisch signifikanten Anstieg der SMR bei Kindern im zweiten Lebensjahr innerhalb von zwei Tagen nach der Impfung mit Hexavac® (einer von zwei zugelassenen sechswertigen Impfstoffen, die inzwischen abgesetzt wurden).
In den Berichten über regelmäßige Sicherheitsupdates bewertet GSK, die Produktionsfirma von Infanrix hexa, ob die Anzahl der nach der Impfung mit ihrem Medikament gemeldeten plötzlichen Todesfälle die zufällig zu erwartende Anzahl überschritten hat. Die Gruppierung der Todesfälle unmittelbar nach der Immunisierung legt nahe, dass der Tod möglicherweise durch den Impfstoff verursacht wurde.
Darüber hinaus zeigt unsere Analyse, dass die in PSUR 16 festgestellten Todesfälle aus PSUR 19 eliminiert wurden. Die beobachteten Todesfälle werden spontan an GSK gemeldet und sind wahrscheinlich unterschätzt. Durch die Addition der aus PSUR 16 geklärten Todesfälle ergibt sich ein statistisch signifikanter Anstieg des Todesrisikos in den ersten vier Tagen nach der Impfung im Vergleich zu den erwarteten Todesfällen. Die Hersteller müssen erklären, warum diese Todesfälle nicht in PSUR 19 enthalten waren. Das erhöhte Todesrisiko wurde der Aufsichtsbehörde oder dem Gesundheitspersonal, das diesen Impfstoff verabreicht, nicht mitgeteilt.
Vor diesem Hintergrund ist es schwierig zu verstehen, wie die EMA PSUR 19 nominal akzeptiert hat. Es kann argumentiert werden, dass keine Sorgfaltspflicht angewendet wurde, so dass viele Kinder unnötig dem Risiko des Todes ausgesetzt waren.
DCGI muss auf die Einschränkungen des Infanrix Hexa PSUR aufmerksam gemacht werden.

