El informe que destaca el ocultamiento de las muertes infantiles posteriores a la vacunación.

Dos médicos en Nueva Delhi informaron un intento de un fabricante multinacional de medicamentos para ocultar muertes repentinas en recién nacidos después de que se administrara la vacuna. Jacob Puliyel, pediatra en el hospital Santo Stefano y C. Sathyamala, epidemiólogo, informaron sobre su descubrimiento en el Indian Journal of Medical Ethics.
La vacuna en cuestión, "Infanrix hexa", que combina las vacunas contra la difteria, el tétanos, la tos ferina, la hepatitis B, la poliomielitis y la gripe tipo B, es producida por GlaxoSmithKline (GSK) y se introdujo en Europa en octubre de 2000.
Puliyel y Sathyamala descubrieron el ocultamiento al analizar los datos en los informes periódicos de actualización de seguridad (PSUR) relacionados con la vacuna que su fabricante GSK debe proporcionar regularmente a la Agencia Europea de Medicamentos (EMA).
Puliyel recibió estos informes confidenciales de seguridad sobre esta vacuna de un investigador italiano que los obtuvo de la EMA en virtud de la Ley de Libertad de Información, la versión italiana del derecho a la información en la India.
Según el análisis, los médicos encontraron que el último informe de seguridad de la vacuna "Infanrix hexa" presentado por GSK (2015) ha cancelado las muertes previamente informado por el fabricante en su 16 ° informe (2012). Sin embargo, señalan que no está claro en el informe cómo se cancelaron estas muertes.
Los autores Puliyel y Sathyamala señalan que diez años después de la publicación de un artículo del Centro para el Control de Enfermedades (CDC) que examina la relación entre MMR y autismo, uno de los autores William Thompson admitió que él y sus coautores habían omitido información. estadísticamente significativo, es decir, que los hombres afroamericanos que recibieron la vacuna MMR antes de los 36 meses tenían un mayor riesgo de autismo. Después de que Thompson y sus colegas encontraron evidencia de este mayor riesgo, eliminaron datos de niños sin certificados de nacimiento georgianos (y por lo tanto descalificaron a un número desproporcionado de niños negros) y presentaron sus datos diciendo que no había mayor riesgo de autismo. No está claro si los autores de PSUR 19 realizaron una descalificación retroactiva similar de los niños documentados que murieron en PSUR 16.
"Si estas muertes no se resolvieran, las muertes después de la vacunación habrían sido significativamente más altas de lo esperado por casualidad. El fabricante habría tenido que admitir a la EMA que su vacuna fue la causa de esas muertes excesivas".
Puliyel y Sathyamala afirman que el productor "debe explicar las cifras aparentemente defectuosas que ha presentado a las autoridades reguladoras.
Hasta ahora, el fabricante ha afirmado que las muertes reportadas después de la vacuna son "coincidentes" y que habrían tenido lugar en estos niños incluso si no hubieran recibido las vacunas.
Sin embargo, en el comentario de su diario, Puliyel y Sathyamala señalan que su análisis mostró que el 83% de las muertes reportadas ocurrieron inmediatamente después de la vacunación en los primeros 10 días y solo el 17% ocurrió en los siguientes diez días.
"Si se tratara de muertes coincidentes, entonces no se habrían agrupado todos inmediatamente después de la vacunación, sino que se habrían distribuido de manera uniforme durante el período de 20 días".
Puliyel y Sathyamala escriben que cualquier argumento que argumente que las muertes súbitas después de la vacunación se compensan con vidas salvadas por la vacuna no es aceptable, de la misma manera que se consideraría ilegal matar a una persona para usar sus órganos para salvar a otras cinco personas. .
"Ocultar las muertes después de la vacunación puede prevenir o retrasar la evaluación del perfil de seguridad de la vacuna y esto puede conducir a muertes innecesarias y éticamente justificables.
Los autores señalan que Hexavac, una vacuna similar fabricada por Sanofi Pasteur y que también se introdujo en el mercado en 2000, se retiró del mercado europeo en 2005. Se descubrió que la muerte de los niños aumentó a los dos días de la vacunación.
En el contexto indio, los autores señalan que el Controlador General de Drogas de la India (DCGI) debería reconsiderar la política de aprobación automática actual para todas las drogas autorizadas en los Estados Unidos y Europa. "Esta dependencia basada en la debida diligencia por parte de la EMA puede ser incorrecta y debe revisarse".
"Pentavac", producido por el Instituto de Suero de India y comercializado en India, es similar al ahora descontinuado Hexavac e Infanrix Hexa reportados aquí, excepto que la vacuna contra la tos ferina de células enteras es reemplazada por una vacuna acelular y tiene un sexto componente, la vacuna inyectable contra la poliomielitis ".
A la luz de sus comentarios, Puliyel y Sathyamala sugieren que "es imperativo que DCGI esté al tanto de los informes de PSUR proporcionados a la EMA y las preocupaciones planteadas a través de este comentario".
El Estudio
Indian Journal of Medical Ethics Online Publicado por primera vez el 5 de septiembre de 2017
Infanrix hexa y muerte súbita: una revisión de la actualización de los informes periódicos de seguridad presentados a la Agencia Europea de Medicamentos
JACOB PULIYEL, C SATHYAMALA
Autores: Jacob Puliyel (autor correspondiente -
Para citar: Puliyel J, Sathyamala C. Infanrix hexa y muerte súbita: una revisión de los informes periódicos de actualización de seguridad presentados a la Agencia Europea de Medicamentos. India J Med Ética. Publicado en línea el 5 de septiembre de 2017. Corregido el 9 de septiembre de 2017 *. DOI: 10.20529 / IJME.2017.079
Editor de manuscritos: Mala Ramanathan © Indian Journal of Medical Ethics 2017
Resumen
Ha habido varios informes espontáneos de muerte súbita inesperada inmediatamente después de la administración de Infanrix hexa (vacuna combinada contra la difteria, el tétanos, la tos ferina acelular, la poliomielitis inactiva, la hepatitis B y la Haemophilus influenzae tipo B). El fabricante, GlaxoSmithKline (GSK), presenta periódicamente informes confidenciales de actualización de seguridad (PSUR) sobre Infanrix Hexa a la Agencia Europea de Medicamentos (EMA). El último es PSUR * 19. Cada PSUR contiene un análisis de muertes súbitas observadas / esperadas, que muestra que el número de muertes observadas inmediatamente después de la inmunización es menor al esperado por casualidad.
Este comentario se enfoca en ese aspecto del PSUR que afecta las decisiones políticas. Hemos analizado los datos proporcionados en el PSUR. Es evidente que las muertes reconocidas en la PSUR 16 han sido eliminadas por la PSUR 19. La cantidad de muertes observadas inmediatamente después de la vacunación en niños mayores de un año fue significativamente mayor de lo esperado por casualidad una vez que se eliminaron las muertes. restaurado e incluido en el análisis.
El fabricante debe explicar las cifras que se han presentado a las autoridades reguladoras. Es necesario revisar los procedimientos realizados por la EMA para evaluar las alertas del fabricante en el PSUR. El Controlador General de Medicamentos de la India acepta casi automáticamente medicamentos y vacunas aprobados por la EMA. Es necesario revisar la confianza en la diligencia por parte de la EMA.
Introducción
El 23 de octubre de 2000, la comercialización de dos vacunas hexavalentes, Infanrix hexa® (GlaxoSmithKline plc-GSK) y Hexavac® (Sanofi Pasteur MSD, SNC), que combinan difteria, tétanos, tos ferina acelular, hepatitis B, la La poliomielitis inactivada y la influenza Haemophilus tipo B han sido autorizadas en la Unión Europea. Después de la autorización, hubo varios informes espontáneos de muerte súbita inesperada inmediatamente después de la administración de estas vacunas hexavalentes. En 2005, von Kries y colegas (1) realizaron un análisis detallado en el que compararon las muertes observadas inmediatamente después de la vacunación con las víctimas esperadas. Descubrieron que la tasa de mortalidad estandarizada (SMR) dentro de los dos días posteriores a la vacunación con Hexavac había aumentado significativamente en los niños vacunados en el segundo año de vida.
Este no fue el caso con Infanrix Hexa. A petición del titular de la autorización de comercialización, Hexavac se retiró en 2005 e Infanrix Hexa continuó comercializándose en Europa (2). Según la ley europea, la Agencia Europea de Medicamentos (EMA) es responsable de proteger la salud pública a través de la evaluación de medicamentos aprobados por ella como autoridades reguladoras. Los fabricantes son responsables de la eficacia, calidad y seguridad de sus medicamentos (3).
El tribunal de justicia italiano Nicola Di Leo ha puesto a disposición del público los informes periódicos de actualización de seguridad confidencial (PSUR) 15 y 16a de 2009 a 2011 de GlaxoSmithKline (4). El PSUR 19 (que incorpora los PSUR 17, 18 y 19, de fecha 15 de enero de 2015) fue obtenido por un investigador italiano de la EMA de conformidad con el artículo 3 de las normas de la EMA (EMA 110196/2006 de 30 de noviembre de 2010) (5). ). El médico italiano envió este PSUR al primer autor (JP), pidiéndole que escribiera un informe para ser presentado al Parlamento Europeo. Este comentario se basa en todos estos PSUR. En el contexto del aspecto de seguridad previamente destacado por von Kries (1), este comentario examina la muerte súbita después del uso de la vacuna Infanrix Hexa. No se examinan otros aspectos cubiertos en el IPS.
PSUR 15 - agrupación de muertos después de la vacunación
La mayoría de las muertes que ocurren en el período post-neonatal se deben a infecciones, defectos de nacimiento, neoplasias o accidentes. Los niños rara vez mueren sin una causa obvia y, por lo tanto, las muertes se clasifican como (i) síndrome de muerte súbita (SMSL), definido en el PSUR como la muerte que ocurre en el primer año de vida y permanece sin explicación después de la autopsia, o (ii ) muerte súbita inesperada (SUR), definida como la muerte que ocurre dentro de los primeros dos años de vida, y que permanece sin explicación después de la historia clínica y final de los eventos, pero sin una autopsia. Juntos, estos dos se consideran muerte súbita (DE) en PSUR 15. Se administra un cierto número de vacunas a niños menores de 2 años en un día determinado, y el número de niños vacunados en todo el mundo es muy grande. Es posible que algunos niños vacunados mueran accidentalmente de SMSL / SUR incidentalmente, tales eventos habrían ocurrido incluso si estos niños no hubieran sido vacunados ese día. Para determinar si dicha muerte fue causada por la vacuna o si fue un evento incidental, se realiza un análisis SD observado / esperado. El análisis evalúa si el número de muertes observadas después de la vacunación excede lo que se puede predecir por casualidad.
Muertes súbitas: observadas hacia las expectativas
PSUR 15 explica cómo se realizó este análisis (4: p 782): "La Sociedad evaluó si el número de muertes súbitas reportadas en este grupo de edad que excedió el número uno podría ocurrir al azar. Desde la distribución de edad cuando se desconoce a los sujetos vacunados, la empresa asumió que la proporción de eventos adversos por edad es representativa de la distribución de edad real en el momento de la vacunación. Por lo tanto, se puede estimar que el 90,6% de todos los que recibieron Infanrix Hexa estaba en su primer año de vida y el 9,4% en el segundo año de vida. Por lo tanto, el número de dosis (desde el lanzamiento) se estimó en 54.927.729 y 5,698,904, respectivamente. Dado que Alemania es el principal país donde se distribuyen las dosis de Infanrix Hexa (casi el 30% sólo en Alemania), se supuso que la incidencia de muerte súbita observada en Alemania era representativa de toda la población receptora de Infanrix Hexa (Oficina FederalEstadística alemana, Statistisches Bundesamt; tasa de incidencia en el primer año de vida: 0,454 / 1000 nacidos vivos; segundo año: 0.062 / 1000 nacidos vivos, datos de 2008).
"El PSUR documenta la muerte informada dentro de los 20 días posteriores a la vacunación. El número de muertes observado fue menor de lo esperado (tabla 1).
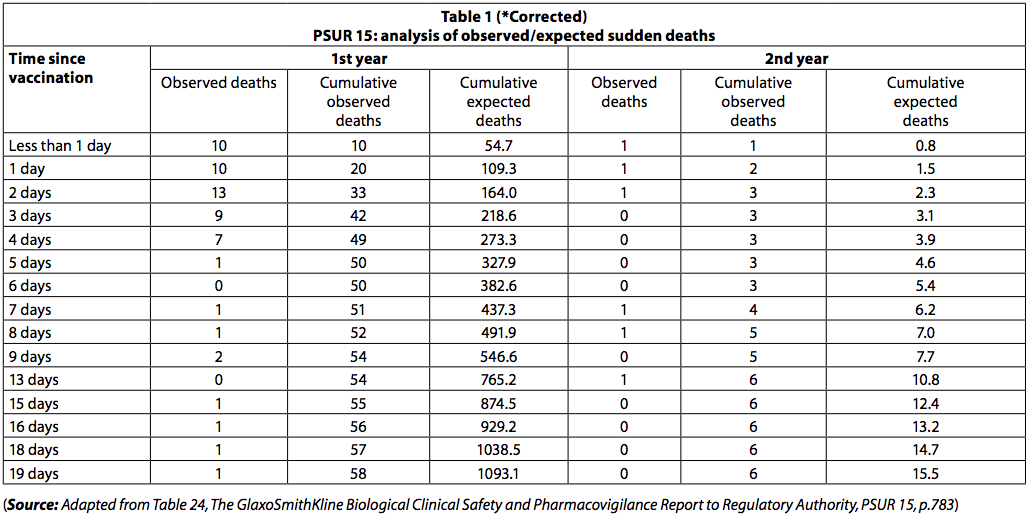
Sin embargo, entre los recién nacidos, hubo un grupo de muertes inmediatamente después de la vacunación, con 42 muertes ocurridas en los primeros tres días después de la vacunación y solo 8 en los siguientes 3 días. Entre los menores de un año, se produjeron 54 muertes (93%) en los primeros diez días y 4 (7%) en los 10 días siguientes. Si las muertes hubieran sido "muertes aleatorias por SMSL", esta disparidad en el número de muertes durante los dos períodos de tiempo no se habría observado.
Las muertes por SMSL se habrían distribuido uniformemente durante el período de 20 días.
El hecho de que la tasa de mortalidad descienda rápidamente con el paso del tiempo después de la inmunización sugiere que las muertes pueden estar relacionadas con la vacunación.
De manera similar, entre los niños mayores de un año, ocurrieron 5 muertes (83,3%) en los primeros 10 días y una muerte (17%) en los siguientes 10 días. La agrupación de muertes reportadas en PSUR 15 también se observó en PSUR 16, y esto se ha comentado anteriormente (6).
La respuesta de GlaxoSmithKline
En respuesta a esta crítica (7), el director ejecutivo (CEO) de GlaxoSmithKline (GSK), Sir Andrew Witty, a través del Dr. Norman Begg, director médico de la compañía, sugirió en una carta que es mucho más probable pensar en una posible asociación causal y luego informar un evento adverso a GSK si ocurre poco después de la vacunación en lugar de semanas después. Además, escribió: "A la luz de lo anterior, seguimos confiando en las conclusiones a las que llegó anteriormente GSK y las compartió con las agencias reguladoras y las autoridades sanitarias de todo el mundo, que los datos actualmente disponibles no sugieren un mayor riesgo de muerte súbita infantil después de vacunación con Infanrix hexa. En caso de que los datos y la información disponibles cambien y sugieran que existe un mayor riesgo, mantenemos nuestro compromiso de notificar de inmediato a las autoridades y tomar las medidas necesarias para comunicar dichos datos e información a los profesionales sanitarios ".
Esta respuesta contiene una admisión tácita de que no hubo vigilancia activa durante el período posterior a la vacunación y solo las muertes informadas espontáneamente a GSK se incluyeron bajo el título "muertes observadas". Esto podría causar una subestimación de las muertes después de la vacunación. Cabe señalar que el número de dosis de vacuna distribuidas se utiliza para las "muertes esperadas". El informe reconoce que todas las dosis de la vacuna distribuida no se han utilizado necesariamente. De esta manera, se infló el número de "muertes esperadas".
Sin embargo, dada la explicación y la garantía del CEO de que GSK se ha comprometido a notificar de inmediato a las autoridades y a los profesionales de la salud sobre cualquier riesgo mayor con Infanrix Hexa, el tema de la agrupación de muertes no se ha investigado más a fondo.
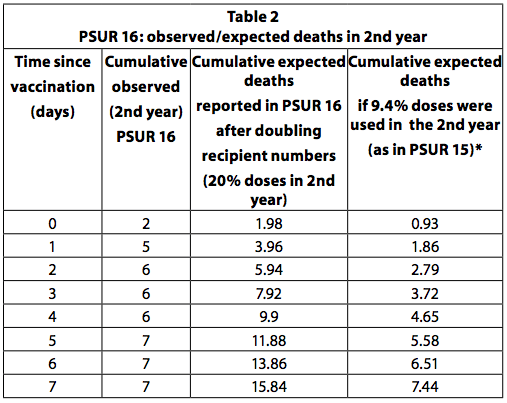
PSUR 16: duplicación de las muertes esperadas
Si todos los niños que recibieron la primera dosis de la vacuna reciben un total de cuatro dosis y la última dosis se administra en el segundo año de vida, entonces se puede estimar que una cuarta parte (25%) de las dosis se administra a niños mayores a un año Este es el calendario de vacunación recomendado en Alemania. Sin embargo, algunos países, como Italia, recomiendan solo tres dosis, todas en el primer año y ninguna en el segundo. Además, no todos los niños reciben todas las dosis recomendadas. Por lo tanto, es poco probable que el 20-25% de las dosis se usen en el segundo año. En la PSUR 15, se estimó que el 90,6% de las dosis vendidas se usaron en lactantes menores de un año y el 9,4% en los mayores de un año. En PSUR 16, la estimación de las dosis recibidas en el segundo año se ha más que duplicado (del 9,4% al 20%) y, por lo tanto, la estimación de las muertes esperadas se ha duplicado. A pesar de la duplicación de las muertes esperadas, el número de muertes observadas en el segundo año fue mayor de lo esperado en los primeros 3 días después de la vacunación (Tabla 36, p249). Si la estimación en PSUR 15 de que el 9,4% de las dosis se usan en el segundo año es correcta, esto también se aplica a PSUR 16 y, por lo tanto, las muertes observadas son más altas que las esperadas en los primeros 7 días.
PSUR 19: muertes predichas ponderadas por país y proporción anual de dosis
En PSUR 19, se calculó un promedio ponderado por calendario de las tasas de incidencia de muertes súbitas de Alemania, Francia y los Países Bajos para llegar a la incidencia esperada de muertes súbitas.
En términos muy simples, esto significa que si el 60% de las dosis se distribuyeron en Alemania en un año determinado, la tasa de SD (muerte súbita) en Alemania obtendría un peso del 60% al calcular la tasa de SD. en general para ese año; si el 30% se distribuyó en Francia, la tasa SD en Francia contribuyó con el 30%, y el peso del 10% se asignó a la tasa SD holandesa. Finalmente, la tasa global de DE se calculó para todos los años juntos.
La tasa general de DE se calculó como 0.0102 / 1000 nacidos vivos para el segundo año. Esta cifra es una sexta parte de la frecuencia esperada utilizada en PSUR 15 y 16 (que calculó muertes súbitas en 0,062 / 1000 nacimientos vivos, utilizando datos alemanes).
El intervalo de confianza de Poisson (IC) del 95% de las muertes observadas en el segundo año se informa en la tabla 8 ap 447 del PSUR 19. Se informa que para el segundo año de vida, el número de muertes observadas fue mayor, también si no significativamente, que el de las muertes esperadas dentro de un período de riesgo de 1-4 días después de la vacunación.
Muertes desaparecidas en PSUR 19
Del PSUR 16 al PSUR 19, las dosis totales de vacuna aumentaron de 69 a 112 millones. Según el IPS 19, se asumió que el 20,2% de las dosis distribuidas se administraron a niños en el segundo año de vida (IPS 19, págs. 436-448). Se excluyeron los casos de muerte en los que se desconoce la edad de vacunación, no se registró la fecha de la muerte o el tiempo de muerte excedió los 19 días desde la vacunación.
El PSUR 19 (muertes hasta el 22 de octubre de 2014) no informa las muertes repentinas mencionadas en el PSUR 16 (casos de muerte ocurridos hasta el 22 de octubre de 2011). Cabe señalar que en PSUR 16 se registraron la edad del niño que murió después de la vacunación y el momento de la muerte (dentro de los 14 días posteriores a la vacunación).
Las muertes acumuladas informadas son más bajas en la PSUR 19 que en la PSUR 16. En cuanto a los niños mayores de un año, la PSUR 19 registra la ocurrencia de solo 5 muertes en los primeros 19 días después de la vacunación, mientras que la PSUR 16 informa 8 Los números no son consistentes entre sí. Nos preguntamos por qué es así.
Diez años después de la publicación del artículo de los CDC (Centro para el Control de Enfermedades) que examina la relación entre la vacuna contra el sarampión, las paperas y la rubéola (MMR) y el autismo (8), uno de los autores, William Thompson, admitió que él y sus coautores no pudieron mostrar información estadísticamente significativa de que los hombres afroamericanos que recibieron MMR antes de los 36 meses tenían un mayor riesgo de autismo (9). Los autores eliminaron los datos de los niños que no tenían actas de nacimiento en Georgia (10), para excluir un número desproporcionado de niños negros, y presentaron sus datos para mostrar que no había habido un aumento en el riesgo.
No está claro si los autores de PSUR 19 han descartado de manera similar niños muertos y documentados en PSUR 16.
La Tabla 3 presenta las muertes observadas y esperadas reportadas en PSUR 19 y las muertes observadas después de la restauración de las muertes reportadas en PSUR 16.
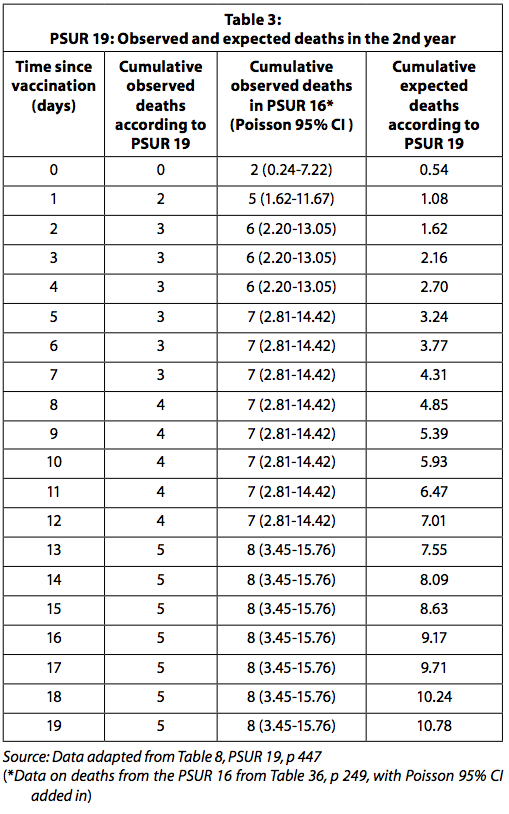
Cuando se utilizan los datos de muertes observadas en PSUR 16, el número de muertes observadas es significativamente mayor de lo esperado durante los primeros cuatro días después de la vacunación. Debe tenerse en cuenta, como se explicó anteriormente, que dado que el número de muertes observadas se recopila de forma pasiva, es probable que se subestime. Por otro lado, es probable que las muertes esperadas estén sobreestimadas, ya que se calculan con el supuesto de que todas las dosis distribuidas se han utilizado sin ninguna pérdida y no se ha descartado ninguna vacuna porque ha caducado. Se esperaba que GSK informara el aumento estadísticamente significativo del riesgo de muerte en los cuatro días posteriores a la vacunación a la autoridad reguladora y a los médicos.
Las dosis utilizadas en el segundo año.
PSUR 19 supone que el 20,2% de las dosis se han usado en el segundo año. Establece que se desconoce la distribución de la edad a la que se vacunan los sujetos, y la compañía ha especulado que la proporción de eventos adversos (incluida la muerte) por edad es representativa de la distribución de edad real en la vacunación. Por lo tanto, dado que el 20,2% de los eventos adversos ocurrieron en niños mayores de un año de edad, la compañía asumió que el 20,2% de las dosis se han utilizado para este grupo de edad.
Es fácil estimar la cantidad de dosis utilizadas en el segundo año en función de los eventos adversos observados (incluida la muerte), luego usar esta estimación de dosis para calcular la cantidad de muertes esperadas y finalmente compararla con la cantidad de muertes observadas, dado que La estimación de las muertes esperadas se calcula principalmente a partir de los eventos negativos observados (incluida la muerte).
Asumiendo que todas las muertes después de la vacunación son SIDS / SUR relacionados con vacunas coincidentes y no causales, y dado que (según PSUR 19) la frecuencia natural de muerte súbita en el primer año es 44 veces mayor que en el segundo año (0.441 / 1000 en el primer año y 0.0102 / 1000 en el segundo año), 44 veces más niños deben ser vacunados en el segundo año para alcanzar el mismo número de muertes que en el primer año.
En una cohorte de 100 muertes, si el 20% de las muertes repentinas ocurren en el segundo año y el 80% en el primer año, 880 niños deben ser vacunados en el segundo año por cada 20 vacunados en el primer año. En este caso, se supondría que el 44% de todas las dosis de Infanrix hexa se habrían usado en el segundo año y solo el 80% en el primer año (en lugar de lo contrario). Esto refleja lo absurdo de calcular la distribución de dosis por edad, en función de la distribución por edad de los eventos adversos, como se hace en el documento GSK.
La única forma de evaluar la cantidad de dosis utilizadas en el segundo año es observar los calendarios de vacunación en diferentes países, observando qué países recomiendan la cuarta dosis en el segundo año y cuáles no recomiendan las dosis en el segundo año. Se puede asignar un peso para la cantidad de dosis distribuidas en estos países. La tasa de abandono (niños que abandonan el programa de vacunación después de recibir las primeras dosis de la vacuna) también debe considerarse en el cálculo final del porcentaje de dosis utilizadas en el segundo año. Parece que una estimación razonable de las dosis utilizadas en el segundo año es del 9,4% de las dosis totales y esta es la cifra utilizada en el PSUR 15.
El dilema ético: el problema del carro
Este comentario no intenta examinar si estas muertes excesivas después de la vacunación (presumiblemente causadas por la vacuna) pueden compensarse con las vidas salvadas por la enfermedad con la prevención obtenida con la vacuna. En su clásico experimento mental, llamado el dilema del carro, Philippa Foot pregunta si es ético redirigir un carro que se escapó de una vía férrea que habría matado a cinco personas en otra vía donde solo uno habría muerto (11). . En una variante del dilema del carro, la persona soltera en la pista alternativa es el hijo de la persona que puede cambiar las pistas.[ 2 ] Judith Thomson asume que los trasplantes de órganos de un donante sano pueden salvar cinco vidas y pregunta si sería ético matar intencionalmente a una persona para salvar a las otras cinco (12). La ética argumenta que el fin no puede justificar los medios. Si oculta la muerte después de la vacunación, puede prevenir / retrasar la evaluación del perfil de seguridad de la vacuna y esto tiene el potencial de causar más muertes innecesarias, difíciles de justificar éticamente.
Relevancia para la India
La autoridad reguladora del gobierno de la India es el Contralor General de Drogas de la India (DCGI). De acuerdo con las normas de DCGI, los medicamentos aprobados en uno o más países, como los Estados Unidos, el Reino Unido, Canadá, Japón, Australia y los países de la Unión Europea, también están aprobados en la India (13). Solo se necesitan estudios adicionales para evaluar el impacto de los factores étnicos en la eficacia, seguridad, dosificación y regímenes de dosificación de medicamentos (14).
Recientemente, se han publicado en la India estudios que examinan la inmunogenicidad y la seguridad de la vacuna combinada hexavalente en pequeños ensayos (15,16). Además, Indian Pediatrics publicó un editorial titulado "Vacunas hexavalentes: ¿El futuro de la inmunización de rutina?" (17), quien sugirió que esta vacuna combinada se promovería en la India. Es vital que la autoridad reguladora de la India sea consciente de las preocupaciones planteadas en este comentario sobre los informes del IPS, en particular porque los sistemas de vigilancia de la India son débiles.
Resumen y conclusión
Von Kries (1) informó un aumento estadísticamente significativo de SMR en niños en su segundo año de vida, dentro de los dos días posteriores a la vacunación con Hexavac® (una de las dos vacunas hexavalentes autorizadas, ahora retirada).
En los informes periódicos de actualización de seguridad, GSK, la compañía productora de Infanrix hexa, evalúa si el número de muertes repentinas reportadas después de la vacunación con su medicamento ha excedido el número que podría esperarse por casualidad. La agrupación de muertes inmediatamente después de la vacunación sugiere que la muerte pudo haber sido causada por la vacuna.
Además, nuestro análisis muestra que las muertes reconocidas en la PSUR 16 se han eliminado de la PSUR 19. Las muertes observadas se informan espontáneamente a GSK y es probable que se subestimen. Al agregar muertes eliminadas de PSUR 16, hay un aumento estadísticamente significativo en el riesgo de muerte en los primeros cuatro días después de la vacunación, en comparación con las muertes esperadas. Los fabricantes deberán explicar por qué estas muertes no se incluyeron en la PSUR 19. El mayor riesgo de muerte no se divulgó a la autoridad reguladora ni al personal de atención médica que administra esta vacuna.
Dado lo anterior, es difícil entender cómo EMA pudo haber aceptado PSUR 19 de manera nominal. Se puede argumentar que no se ha ejercido la diligencia debida, por lo que muchos niños han estado expuestos innecesariamente al riesgo de muerte.
DCGI debe ser consciente de las limitaciones en el PSUR Infanrix Hexa.

