Infanrix hexa et mort subite: un examen de la mise à jour des rapports de sécurité périodiques soumis à l'Agence européenne des médicaments

Le vaccin en question, "Infanrix hexa", qui combine les vaccins contre la diphtérie, le tétanos, la coqueluche, l'hépatite B, la polio et la grippe de type B, est produit par GlaxoSmithKline (GSK) et a été introduit en Europe en octobre 2000.
Puliyel et Sathyamala ont découvert la dissimulation en analysant les données des rapports périodiques actualisés de sécurité (PSUR) relatifs au vaccin que son fabricant GSK doit régulièrement fournir à l'Agence européenne des médicaments (EMA).
Ces rapports de sécurité confidentiels sur ce vaccin ont été reçus par Puliyel d'un chercheur italien qui les a obtenus de l'EMA en vertu de la Freedom of Information Act - la version italienne du droit à l'information en Inde.
Selon l'analyse, les médecins ont constaté que le dernier rapport sur l'innocuité du vaccin "Infanrix hexa" présenté par GSK (2015) a annulé les décès précédemment signalé par le fabricant dans son 16e rapport (2012). Ils notent cependant que le rapport ne précise pas comment ces décès ont été annulés.
Les auteurs Puliyel et Sathyamala notent que dix ans après la publication d'un article du Center for Disease Control (CDC) examinant la relation entre le ROR et l'autisme, l'un des auteurs William Thompson a admis que lui et ses coauteurs avaient omis des informations. statistiquement significatif - c'est-à-dire que les hommes afro-américains qui avaient reçu le vaccin ROR avant l'âge de 36 mois couraient un risque accru d'autisme. Après que Thompson et ses collègues ont trouvé des preuves de ce risque accru, ils ont supprimé les données des enfants sans certificats de naissance géorgiens (et ont donc disqualifié un nombre disproportionné d'enfants noirs) et ont présenté leurs données en disant qu'il n'y avait pas risque accru d'autisme. Il n'est pas clair si les auteurs du PSUR 19 ont procédé à une disqualification rétroactive similaire des enfants dont la mort par le PSUR 16 a été documentée.
"Si ces décès n'avaient pas été éliminés, les décès après vaccination auraient été significativement plus élevés que prévu par hasard. Le fabricant aurait dû admettre à l'EMA que leur vaccin était la cause de ces décès excessifs."
Puliyel et Sathyamala affirment que le producteur "doit expliquer les chiffres apparemment erronés qu'il a soumis aux autorités réglementaires.
Jusqu'à présent, le fabricant a affirmé que les décès signalés après le vaccin étaient "coïncidents" et qu'ils se seraient produits chez ces enfants même s'ils n'avaient pas été vaccinés.
Cependant, dans leur commentaire de journal, Puliyel et Sathyamala soulignent que leur analyse a montré que 83% des décès signalés sont survenus immédiatement après la vaccination au cours des 10 premiers jours et que 17% seulement sont survenus au cours des dix jours suivants.
"S'il s'agissait de décès par coïncidence, ils n'auraient pas tous été regroupés immédiatement après la vaccination, mais auraient été répartis également sur la période de 20 jours."
Puliyel et Sathyamala écrivent que tout argument qui prétend que les morts subites après la vaccination sont compensées par des vies sauvées par le vaccin n'est pas acceptable, de la même manière qu'il serait considéré illégal de tuer une personne pour utiliser ses organes pour sauver cinq autres personnes. .
"Cacher les décès après la vaccination peut empêcher ou retarder l'évaluation du profil de sécurité du vaccin et cela peut entraîner des décès inutiles et éthiquement justifiables.
Les auteurs soulignent que Hexavac - un vaccin similaire fabriqué par Sanofi Pasteur et également introduit sur le marché en 2000 a été retiré du marché européen en 2005. Il a été constaté que la mort d'enfants augmentait dans les deux jours suivant la vaccination.
Dans le contexte indien, les auteurs soulignent que le Drug Controller General of India (DCGI) devrait reconsidérer la politique d'approbation automatique actuelle pour tous les médicaments autorisés aux États-Unis et en Europe. "Cette confiance fondée sur la diligence raisonnable de l'EMA peut être erronée et doit être revue."
Le "Pentavac", produit par le Serum Institute of India et commercialisé en Inde, est similaire à Hexavac et Infanrix Hexa, désormais abandonné, mais présenté ici, sauf que le vaccin anticoquelucheux à cellules entières est remplacé par un vaccin acellulaire et a un sixième composant, le vaccin antipoliomyélitique injectable. "
À la lumière de leurs commentaires, Puliyel et Sathyamala suggèrent qu '"il est impératif que DCGI soit au courant des rapports PSUR fournis à l'EMA et des préoccupations soulevées à travers ce commentaire".
studio
Indian Journal of Medical Ethics Online Première publication le 5 septembre 2017
Infanrix hexa et mort subite: un examen de la mise à jour des rapports de sécurité périodiques soumis à l'Agence européenne des médicaments
JACOB PULIYEL, C SATHYAMALA
Auteurs: Jacob Puliyel (auteur correspondant -
Pour citer: Puliyel J, Sathyamala C. Infanrix hexa et la mort subite: un examen des rapports périodiques actualisés de sécurité soumis à l'Agence européenne des médicaments. Indian J Med Ethics. Publié en ligne le 5 septembre 2017. Corrigé le 9 septembre 2017 *. DOI: 10.20529 / IJME.2017.079
Éditrice du manuscrit: Mala Ramanathan © Indian Journal of Medical Ethics 2017
Abstract
Il y a eu plusieurs rapports spontanés de mort subite inattendue immédiatement après l'administration d'Infanrix hexa (diphtérie combinée, tétanos, vaccin anticoquelucheux acellulaire, poliomyélite inactivée, hépatite B et Haemophilus influenzae type B). Le fabricant, GlaxoSmithKline (GSK), soumet à l'Agence européenne des médicaments (EMA) des rapports périodiques confidentiels de mise à jour de la sécurité (PSUR) sur Infanrix Hexa. Le dernier est le PSUR * 19. Chaque PSUR contient une analyse des morts subites observées / attendues, qui montre que le nombre de décès observés immédiatement après la vaccination est inférieur à celui attendu par hasard.
Ce commentaire se concentre sur cet aspect du PSUR qui affecte les décisions politiques. Nous avons analysé les données fournies dans le PSUR. Il est évident que les décès reconnus dans le PSUR 16 ont été éliminés par le PSUR 19. Le nombre de décès observés immédiatement après la vaccination chez les enfants de plus d'un an était significativement plus élevé que prévu par hasard une fois les décès effacés restauré et inclus dans l'analyse.
Le fabricant doit expliquer les chiffres qui ont été soumis aux autorités réglementaires. Les procédures entreprises par l'EMA pour évaluer les alertes du fabricant dans le PSUR doivent être revues. Le contrôleur général des médicaments de l'Inde accepte presque automatiquement les médicaments et vaccins approuvés par l'EMA. Il est nécessaire de revoir la confiance dans la diligence de l'EMA.
Introduction
Le 23 octobre 2000, la commercialisation de deux vaccins hexavalents, Infanrix hexa® (GlaxoSmithKline plc-GSK) et Hexavac® (Sanofi Pasteur MSD, SNC), qui associent diphtérie, tétanos, coqueluche acellulaire, hépatite B, la la poliomyélite inactivée et la grippe Haemophilus type B ont été autorisées dans l'Union européenne. Après autorisation, il y a eu plusieurs rapports spontanés de mort subite inattendue immédiatement après l'administration de ces vaccins hexavalents. En 2005, von Kries et ses collègues (1) ont effectué une analyse détaillée dans laquelle ils ont comparé les décès observés immédiatement après la vaccination avec les pertes attendues. Ils ont constaté que le taux de mortalité standardisé (SMR) dans les deux jours suivant la vaccination par Hexavac avait considérablement augmenté chez les enfants vaccinés au cours de la deuxième année de vie.
Ce n'était pas le cas avec Infanrix Hexa. À la demande du titulaire de l'autorisation de mise sur le marché, Hexavac a été retiré en 2005 et Infanrix Hexa a continué à être commercialisé en Europe (2). Selon le droit européen, l'Agence européenne des médicaments (EMA) est responsable de la protection de la santé publique grâce à l'évaluation des médicaments approuvés par elle en tant qu'autorités réglementaires. Les fabricants sont responsables de l'efficacité, de la qualité et de l'innocuité de leurs médicaments (3).
La cour de justice italienne Nicola Di Leo a mis à la disposition du public les rapports périodiques confidentiels de mise à jour de sécurité (PSUR) 15 et 16a de 2009 à 2011 de GlaxoSmithKline (4). Le PSUR 19 (qui intègre les PSUR 17, 18 et 19 du 15 janvier 2015) a été obtenu par un chercheur italien de l'EMA conformément à l'article 3 du règlement EMA (EMA 110196/2006 du 30 novembre 2010) (5). ). Le médecin italien a envoyé ce PSUR au premier auteur (JP), lui demandant de rédiger un rapport à présenter au Parlement européen. Ce commentaire est basé sur tous ces PSUR. Dans le cadre de l'aspect sécurité précédemment souligné par von Kries (1), ce commentaire examine la mort subite après l'utilisation du vaccin Infanrix Hexa. D'autres aspects couverts par le PSUR ne sont pas examinés.
PSUR 15 - regroupement des morts après vaccination
La plupart des décès qui surviennent dans la période post-néonatale sont dus à des infections, des malformations congénitales, des tumeurs malignes ou des accidents. Les enfants meurent rarement sans cause évidente et les décès sont donc classés comme (i) syndrome de mort subite (SMSN), défini dans le PSUR comme un décès qui survient au cours de la première année de vie et reste inexpliqué après l'autopsie, ou (ii ) mort subite inattendue (SUD), définie comme la mort qui survient au cours des deux premières années de vie, et qui reste inexpliquée après l'histoire clinique et finale des événements, mais sans autopsie. Ensemble, ces deux sont considérés comme une mort subite (SD) dans le PSUR 15. Un certain nombre de vaccins sont administrés aux enfants de moins de 2 ans un jour donné, et le nombre d'enfants vaccinés dans le monde est très important. Il est possible que certains enfants vaccinés meurent accidentellement des PEID / SUD par accident, de tels événements se seraient produits même si ces enfants n'avaient pas été vaccinés ce jour-là. Pour déterminer si un tel décès a été causé par la vaccination ou s'il s'agissait d'un événement fortuit, une analyse SD observée / attendue est effectuée. L'analyse évalue si le nombre de décès observés après la vaccination dépasse ce qui peut être prédit par hasard.
Mort subite: observée vers les attentes
PSUR 15 explique comment cette analyse a été réalisée (4: p 782): "La Société a évalué si le nombre de morts subites signalées dans ce groupe d'âge qui dépassait le nombre un pouvait survenir au hasard. chez lesquels les sujets ont été vaccinés est inconnue, la société a supposé que la proportion d'événements indésirables par âge est représentative de la répartition réelle par âge au moment de la vaccination. On peut donc estimer que 90,6% de tous les receveurs d'Infanrix Hexa était dans sa première année de vie et 9,4% dans sa deuxième année. Par conséquent, le nombre de doses (depuis le lancement) a été estimé à 54.927.729 5,698,904 30 et 0,454 1000 0.062, respectivement. principal pays où les doses d'Infanrix Hexa sont distribuées (près de 1000% rien qu'en Allemagne), l'incidence de mort subite observée en Allemagne a été supposée représentative de l'ensemble de la population de receveurs d'Infanrix Hexa (Office fédéralStatistiques allemandes, Statistisches Bundesamt; taux d'incidence au cours de la première année de vie: 2008 / XNUMX naissances vivantes; deuxième année: XNUMX / XNUMX naissances vivantes, données XNUMX).
"Le PSUR documente le décès signalé dans les 20 jours suivant la vaccination. Le nombre de morts observé était inférieur aux prévisions (tableau 1).
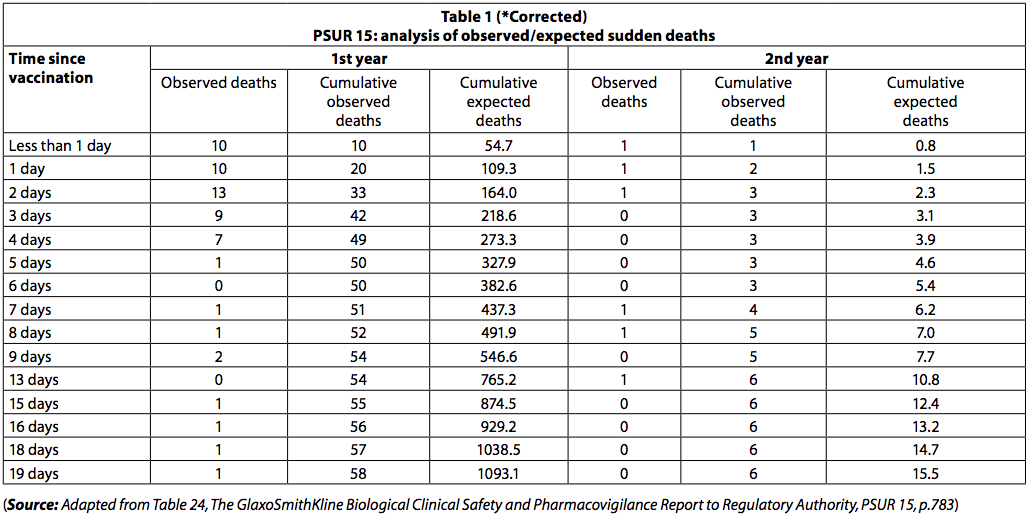
Cependant, parmi les nouveau-nés, il y avait un regroupement de décès immédiatement après la vaccination, avec 42 décès survenus dans les trois premiers jours après la vaccination et seulement 8 dans les 3 jours suivants. Parmi les enfants de moins d'un an, 54 décès (93%) sont survenus au cours des dix premiers jours et 4 (7%) au cours des 10 jours suivants. Si les décès avaient été des «décès aléatoires du SMSN», cette disparité du nombre de décès au cours des deux périodes n'aurait pas été observée.
Les décès dus au SMSN auraient été répartis également sur la période de 20 jours.
Le fait que le taux de mortalité diminue rapidement avec le temps après la vaccination suggère que les décès peuvent être liés à la vaccination.
De même, parmi les enfants de plus d'un an, 5 décès (83,3%) sont survenus au cours des 10 premiers jours et un décès (17%) s'est produit au cours des 10 jours suivants. Le regroupement des décès signalés dans le PSUR 15 a également été noté dans le PSUR 16, et cela a été commenté précédemment (6).
Réponse de GlaxoSmithKline
En réponse à cette critique (7), Sir Andrew Witty, PDG de GlaxoSmithKline (GSK), par l'intermédiaire du Dr Norman Begg, directeur médical de l'entreprise, a suggéré dans une lettre qu'il y a beaucoup plus de chances de penser à une association causale potentielle, puis de signaler un événement indésirable à GSK s'il survient peu de temps après la vaccination plutôt que des semaines plus tard. Il a en outre écrit: «À la lumière de ce qui précède, nous restons confiants dans les conclusions précédemment atteintes par GSK et partagées avec les agences de réglementation et les autorités sanitaires du monde entier, selon lesquelles les données actuellement disponibles ne suggèrent pas un risque accru de mort subite du nourrisson après vaccination par Infanrix hexa. Si les données et informations disponibles changent et suggèrent un risque accru, nous restons déterminés à informer rapidement les autorités et à prendre les mesures nécessaires pour communiquer ces données et informations aux professionnels de santé. "
Cette réponse contient une admission tacite selon laquelle il n'y a pas eu de vigilance active pendant la période post-vaccination et seuls les décès signalés spontanément à GSK ont été inclus sous la rubrique "décès observés". Cela pourrait entraîner une sous-estimation des décès après la vaccination. Il convient de noter que le nombre de doses de vaccin distribuées est utilisé pour les "décès attendus". Le rapport reconnaît que toutes les doses du vaccin distribué n'ont pas nécessairement été utilisées. De cette façon, le nombre de "décès attendus" a été gonflé.
Cependant, étant donné l'explication et l'assurance du PDG que GSK s'est engagée à informer rapidement les autorités et les professionnels de la santé de tout risque accru avec Infanrix Hexa, la question du regroupement des décès n'a pas fait l'objet d'une enquête plus approfondie.
PSUR 16: doublement des décès attendus
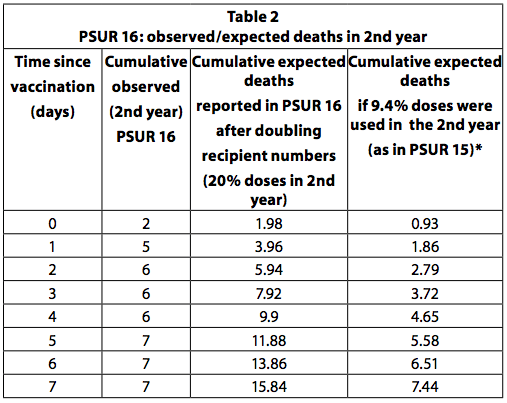
Si tous les enfants qui ont reçu la première dose du vaccin reçoivent un total de quatre doses et que la dernière dose est administrée au cours de la deuxième année de vie, alors on peut estimer qu'un quart (25%) des doses sont administrées à des enfants plus âgés à un an. Il s'agit du calendrier de vaccination recommandé en Allemagne. Cependant, certains pays, comme l'Italie, ne recommandent que trois doses, toutes la première année et aucune la seconde. De plus, tous les enfants ne reçoivent pas toutes les doses recommandées. Il est donc peu probable que 20 à 25% des doses soient utilisées au cours de la deuxième année. Dans le PSUR 15, il a été estimé que 90,6% des doses vendues ont été utilisées chez les nourrissons de moins d'un an et 9,4% pour ceux de plus d'un an. Dans le PSUR 16, l'estimation des doses reçues la deuxième année a plus que doublé (de 9,4% à 20%), et donc l'estimation des décès attendus a doublé. Malgré le doublement des décès attendus, le nombre de décès observés au cours de la deuxième année a été plus élevé que prévu au cours des 3 premiers jours après la vaccination (tableau 36, p249). Si l'estimation du PSUR 15 selon laquelle 9,4% des doses sont utilisées au cours de la deuxième année est correcte, cela s'applique également au PSUR 16 et, par conséquent, les décès observés sont plus élevés que les décès attendus au cours des 7 premiers jours.
PSUR 19: décès prédits pondérés par pays et proportion annuelle des doses
Dans le PSUR 19, une moyenne pondérée par le calendrier des taux d'incidence des morts subites en Allemagne, en France et aux Pays-Bas a été calculée pour arriver à l'incidence attendue des morts subites.
En termes très simples, cela signifie que si 60% des doses étaient distribuées en Allemagne au cours d'une année donnée, le taux SD (Mort subite) en Allemagne avait un poids de 60% lors du calcul du taux SD. globalement pour cette année; si 30% étaient distribués en France, le taux SD en France contribuait à 30%, et le poids de 10% était donné au taux SD néerlandais. Enfin, le taux SD mondial a été calculé pour toutes les années ensemble.
Le taux SD global a été calculé à 0.0102 / 1000 naissances vivantes pour la deuxième année. Ce chiffre est un sixième de la fréquence attendue utilisée dans les PSUR 15 et 16 (qui a calculé les morts subites à 0,062 / 1000 naissances vivantes, en utilisant les données allemandes).
L'intervalle de confiance (IC) de Poisson de 95% des décès observés la deuxième année est rapporté dans le tableau 8 ap 447 du PSUR 19. Il est rapporté que pour la deuxième année de vie, le nombre de décès observés était plus élevé, également sinon significativement, celle des décès attendus dans une période de risque de 1 à 4 jours après la vaccination.
Décès manquants dans le PSUR 19
Du PSUR 16 au PSUR 19, les doses totales de vaccin sont passées de 69 à 112 millions. Selon le PSUR 19, on a supposé que 20,2% des doses distribuées étaient administrées à des enfants au cours de la deuxième année de vie (PSUR 19, pp 436-448). Les cas de décès dans lesquels l'âge de vaccination n'était pas connu, la date du décès n'a pas été enregistrée ou le moment du décès dépassant 19 jours après la vaccination ont été exclus.
Le PSUR 19 (décès jusqu'au 22 octobre 2014) ne rapporte pas les morts subites mentionnées dans le PSUR 16 (cas de décès survenus jusqu'au 22 octobre 2011). Il convient de noter que dans PSUR 16, l'âge de l'enfant décédé après la vaccination et l'heure de la mort (dans les 14 jours suivant la vaccination) ont tous deux été enregistrés.
Les décès cumulés signalés sont plus faibles dans le PSUR 19 que dans le PSUR 16. Quant aux enfants de plus d'un an, le PSUR 19 enregistre la survenue de seulement 5 décès dans les 19 premiers jours après la vaccination, tandis que le PSUR 16 rapporte 8 Les chiffres ne sont pas cohérents les uns avec les autres. Nous nous demandons pourquoi il en est ainsi.
Dix ans après la publication de l'article du CDC (Center for Disease Control) examinant la relation entre le vaccin contre la rougeole, les oreillons et la rubéole (ROR) et l'autisme (8), l'un des auteurs, William Thompson, a admis que lui et ses co-auteurs n'ont pas réussi à montrer des informations statistiquement significatives selon lesquelles les hommes afro-américains qui ont reçu le ROR avant l'âge de 36 mois avaient un risque accru d'autisme (9). Les auteurs ont supprimé les données des enfants qui n'avaient pas de certificat de naissance en Géorgie (10), afin d'exclure un nombre disproportionné d'enfants noirs, et ont présenté leurs données afin de montrer qu'il n'y avait pas eu d'augmentation du risque.
Il n'est pas clair si les auteurs du PSUR 19 ont également exclu les enfants morts et documentés dans le PSUR 16.
Le tableau 3 présente les décès observés et attendus signalés dans le PSUR 19 et les décès observés après la restauration des décès signalés dans le PSUR 16.
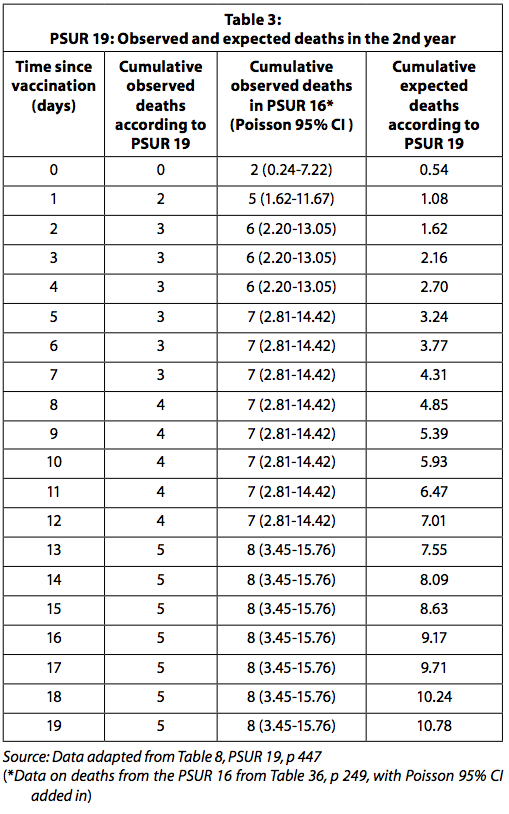
Lorsque les données sur les décès observés dans le PSUR 16 sont utilisées, le nombre de décès observés est significativement plus élevé que prévu pour les quatre premiers jours après la vaccination. Il faut garder à l'esprit, comme expliqué ci-dessus, que le nombre de décès observés étant collecté passivement, il est susceptible d'être sous-estimé. Les décès attendus, en revanche, sont probablement surestimés car ils sont calculés en supposant que toutes les doses distribuées ont été utilisées sans aucune perte et qu'aucun vaccin n'a été jeté parce qu'il a expiré. GSK devait signaler l'augmentation statistiquement significative du risque de décès dans les quatre jours suivant la vaccination à l'autorité de réglementation et aux médecins.
Les doses utilisées en deuxième année
Le PSUR 19 suppose que 20,2% des doses ont été utilisées au cours de la deuxième année. Il indique que la distribution de l'âge auquel les sujets sont vaccinés est inconnue, et la société a émis l'hypothèse que la proportion d'événements indésirables (y compris les décès) par âge est représentative de la distribution réelle de l'âge à la vaccination. Ainsi, puisque 20,2% des événements indésirables sont survenus chez des enfants de plus d'un an, la société a supposé que 20,2% des doses avaient été utilisées pour ce groupe d'âge.
Il est facile d'estimer le nombre de doses utilisées au cours de la deuxième année en fonction des événements indésirables observés (y compris les décès), puis d'utiliser cette estimation de dose pour calculer le nombre attendu de décès, et enfin le comparer avec le nombre de décès observés - étant donné que le L'estimation des décès attendus est calculée principalement à partir des événements négatifs observés (y compris les décès).
En supposant que tous les décès après la vaccination sont des SMSN / SUD coïncidents et non causaux liés au vaccin, et étant donné que (selon le PSUR 19) la fréquence naturelle de la mort subite la première année est 44 fois plus élevée que la deuxième année (0.441 / 1000 la première année et 0.0102 / 1000 la deuxième année), 44 fois plus d'enfants devraient être vaccinés la deuxième année pour atteindre le même nombre de décès que la première année.
Dans une cohorte de 100 décès, si 20% des morts subites surviennent la deuxième année et 80% la première année, 880 enfants doivent être vaccinés la deuxième année pour 20 vaccinés la première année. Dans ce cas, on supposerait que 44% de toutes les doses d'Infanrix hexa auraient été utilisées la deuxième année et seulement 80% la première année (au lieu de l'inverse). Cela reflète l'absurdité du calcul de la distribution des doses par âge, sur la base de la distribution par âge des événements indésirables, comme cela est fait dans le document GSK.
La seule façon d'évaluer le nombre de doses utilisées au cours de la deuxième année consiste à examiner les calendriers de vaccination dans différents pays - en examinant quels pays recommandent la quatrième dose la deuxième année et lesquels ne recommandent pas les doses la deuxième année. Un poids peut être attribué au nombre de doses distribuées dans ces pays. Le taux d'abandon (enfants qui quittent le programme de vaccination après avoir reçu les premières doses de vaccin) doit également être pris en compte dans le calcul final du pourcentage de doses utilisées au cours de la deuxième année. Il semblerait qu'une estimation raisonnable des doses utilisées au cours de la deuxième année représente 9,4% des doses totales et c'est le chiffre utilisé dans le PSUR 15.
Le dilemme éthique - le problème du chariot
Ce commentaire n'essaie pas d'examiner si ces décès excessifs après vaccination (vraisemblablement causés par le vaccin) peuvent être compensés par les vies sauvées par la maladie grâce à la prévention obtenue avec le vaccin. Dans son expérience mentale classique, appelée le dilemme du chariot, Philippa Foot demande s'il est éthique de rediriger un chariot échappé d'une voie ferrée qui aurait tué cinq personnes sur une autre voie où une seule serait morte (11). . Dans une variante du dilemme du chariot, la personne seule sur la piste alternative est l'enfant de la personne qui peut changer de piste. Judith Thomson suppose que cinq vies peuvent être sauvées par des transplantations d'organes d'un donneur en bonne santé et demande s'il serait éthique de tuer intentionnellement une personne pour sauver les cinq autres (12). L'éthique soutient que la fin ne peut pas justifier les moyens. Si vous cachez la mort après la vaccination, vous pouvez empêcher / retarder l'évaluation du profil d'innocuité du vaccin et cela peut entraîner plus de décès inutiles, difficiles à justifier sur le plan éthique.
Pertinence pour l'Inde
L'autorité réglementaire du gouvernement indien est le Drug Controller General of India (DCGI). Selon les règles du DCGI, les médicaments approuvés dans un ou plusieurs pays, tels que les États-Unis, le Royaume-Uni, le Canada, le Japon, l'Australie et les pays de l'Union européenne, sont également approuvés en Inde (13). Seules des études supplémentaires sont nécessaires pour évaluer l'impact des facteurs ethniques sur l'efficacité, l'innocuité, la posologie et les schémas posologiques des médicaments (14).
Récemment, des études examinant l'immunogénicité et l'innocuité du vaccin combiné hexavalent dans de petits essais ont été publiées en Inde (15,16). En outre, Indian Pediatrics a publié un éditorial intitulé "Vaccinations hexavalentes: l'avenir de la vaccination de routine?" (17), qui a suggéré que ce vaccin combiné serait promu en Inde. Il est essentiel que l'autorité de régulation en Inde soit consciente des préoccupations soulevées dans ce commentaire sur les rapports PSUR, d'autant plus que les systèmes de surveillance en Inde sont faibles.
Résumé et conclusion
Von Kries (1) a signalé une augmentation statistiquement significative du SMR chez les enfants au cours de leur deuxième année de vie, dans les deux jours suivant la vaccination avec Hexavac® (l'un des deux vaccins hexavalents autorisés, désormais retiré).
Dans les rapports périodiques de mise à jour de la sécurité, GSK, la société de production d'Infanrix hexa, évalue si le nombre de morts subites signalées après la vaccination avec leur médicament a dépassé le nombre auquel on pouvait s'attendre par hasard. Le regroupement des décès immédiatement après la vaccination suggère que le décès peut avoir été causé par le vaccin.
De plus, notre analyse montre que les décès reconnus dans PSUR 16 ont été éliminés de PSUR 19. Les décès observés sont rapportés spontanément à GSK et sont susceptibles d'être sous-estimés. En ajoutant les décès éliminés du PSUR 16, il y a une augmentation statistiquement significative du risque de décès dans les quatre premiers jours après la vaccination, par rapport aux décès attendus. Les fabricants devront expliquer pourquoi ces décès n'ont pas été inclus dans le PSUR 19. Le risque accru de décès n'a pas été divulgué à l'autorité de réglementation ou au personnel soignant qui administre ce vaccin.
Compte tenu de ce qui précède, il est difficile de comprendre comment l'EMA a pu accepter le PSUR 19 sur une base nominale. On peut affirmer que la diligence raisonnable n'a pas été exercée, de sorte que de nombreux enfants ont été inutilement exposés au risque de mourir.
DCGI doit être informé des limitations du PSUR Infanrix Hexa.

