Infanrix hexa e morte súbita: uma revisão da atualização dos relatórios periódicos de segurança submetidos à Agência Europeia de Medicamentos

A vacina em questão, "Infanrix hexa", que combina vacinas contra difteria, tétano, coqueluche, hepatite B, poliomielite e gripe tipo B, é produzida pela GlaxoSmithKline (GSK) e foi introduzida na Europa em outubro de 2000.
Puliyel e Sathyamala descobriram a ocultação analisando os dados nos relatórios periódicos de atualização de segurança (PSUR) relacionados à vacina que seu fabricante GSK deve fornecer regularmente à Agência Europeia de Medicamentos (EMA).
Esses relatórios confidenciais de segurança sobre esta vacina foram recebidos por Puliyel de um pesquisador italiano que os obteve da EMA sob a Lei de Liberdade de Informação - a versão italiana do direito à informação na Índia.
Segundo a análise, os médicos descobriram que o último relatório de segurança de vacinas "Infanrix hexa" enviado por GSK (2015) cancelou as mortes relatado anteriormente pelo fabricante em seu 16º relatório (2012). Eles observam, no entanto, que não está claro no relatório como essas mortes foram canceladas.
Os autores Puliyel e Sathyamala observam que dez anos após a publicação de um artigo do Centro de Controle de Doenças (CDC) examinando a relação entre MMR e autismo, um dos autores William Thompson admitiu que ele e seus co-autores haviam omitido informações. estatisticamente significante - ou seja, que os homens afro-americanos que receberam a vacina MMR antes dos 36 meses estavam em maior risco de autismo. Depois que Thompson e seus colegas encontraram evidências desse aumento de risco, eles excluíram dados de crianças sem certidão de nascimento georgiana (e, portanto, desqualificaram um número desproporcional de crianças negras) e apresentaram seus dados dizendo que não havia aumento do risco de autismo. Não está claro se os autores do PSUR 19 realizaram uma desqualificação retroativa semelhante de crianças documentadas como mortas no PSUR 16.
"Se essas mortes não fossem apuradas, as mortes após a vacinação teriam sido significativamente maiores do que o esperado por acaso. O fabricante teria que admitir à EMA que a vacina foi a causa dessas mortes em excesso".
Puliyel e Sathyamala afirmam que o produtor "deve explicar os números aparentemente defeituosos que ele submeteu às autoridades reguladoras.
Até agora, o fabricante alegou que as mortes relatadas após a vacina são "coincidentes" e que teriam ocorrido nessas crianças, mesmo que não tivessem sido vacinadas.
No entanto, em seus comentários em periódicos, Puliyel e Sathyamala apontam que suas análises mostraram que 83% das mortes relatadas ocorreram imediatamente após a vacinação nos primeiros 10 dias e apenas 17% ocorreram nos dez dias seguintes.
"Se fossem mortes coincidentes, eles não teriam se agrupado imediatamente após a vacinação, mas teriam sido distribuídos igualmente durante o período de 20 dias".
Puliyel e Sathyamala escrevem que qualquer argumento argumentando que as mortes súbitas após a vacinação são compensadas por vidas salvas pela vacina não é aceitável, da mesma forma que seria considerado ilegal matar uma pessoa para usar seus órgãos para salvar outras cinco pessoas. .
"Ocultar mortes após a vacinação pode impedir ou atrasar a avaliação do perfil de segurança da vacina e isso pode levar a mortes desnecessárias e eticamente justificáveis.
Os autores apontam que o Hexavac - uma vacina semelhante fabricada pela Sanofi Pasteur e também introduzida no mercado em 2000 foi retirada do mercado europeu em 2005. Verificou-se que a morte de crianças aumentou dentro de dois dias após a vacinação.
No contexto indiano, os autores apontam que o Drug Controller General da Índia (DCGI) deve reconsiderar a atual política de aprovação automática de todos os medicamentos autorizados nos Estados Unidos e na Europa. "Essa confiança baseada na devida diligência da EMA pode estar errada e precisa ser revisada."
O "Pentavac", produzido pelo Serum Institute of India e comercializado na Índia, é semelhante ao agora descontinuado Hexavac e Infanrix Hexa relatados aqui, exceto que a vacina contra pertussis de célula inteira é substituída por uma vacina acelular e um sexto componente, a vacina injetável contra a poliomielite ".
À luz de seus comentários, Puliyel e Sathyamala sugerem que "é imperativo que o DCGI esteja ciente dos relatórios do PSUR fornecidos à EMA e das preocupações levantadas por esse comentário".
O Estudo
Indian Journal of Medical Ethics Online First 5 de setembro, 2017 publicado
Infanrix hexa e morte súbita: uma revisão da atualização dos relatórios periódicos de segurança submetidos à Agência Europeia de Medicamentos
JACOB PULIYEL, C SATHYAMALA
Autores: Jacob Puliyel (autor correspondente -
Para citar: Puliyel J, Sathyamala C. Infanrix hexa e morte súbita: uma revisão dos relatórios periódicos de atualização de segurança submetidos à Agência Europeia de Medicamentos. J J Indian Ethics. Publicado online em 5 de setembro de 2017. Corrigido em 9 de setembro de 2017 *. DOI: 10.20529 / IJME.2017.079
Editor de manuscritos: Mala Ramanathan © Indian Journal of Medical Ethics 2017
Sumário
Houve vários relatos espontâneos de morte súbita inesperada imediatamente após a administração de Infanrix hexa (vacina combinada contra difteria, tétano, coqueluche acelular, poliomielite inativada, hepatite B e Haemophilus influenzae tipo B). O fabricante, GlaxoSmithKline (GSK), envia periodicamente relatórios confidenciais de atualização de segurança (PSURs) sobre Infanrix Hexa à Agência Europeia de Medicamentos (EMA). O último é o PSUR * 19. Cada PSUR contém uma análise das mortes súbitas observadas / esperadas, que mostram que o número de mortes observadas imediatamente após a imunização é menor do que o esperado por acaso.
Este comentário enfoca o aspecto do PSUR que afeta as decisões políticas. Analisamos os dados fornecidos no PSUR. É evidente que as mortes reconhecidas no PSUR 16 foram eliminadas pelo PSUR 19. O número de mortes observadas imediatamente após a vacinação em crianças acima de um ano de idade foi significativamente maior do que o esperado por acaso, uma vez que as mortes apuradas foram restaurado e incluído na análise.
O fabricante deve explicar os números que foram enviados às autoridades reguladoras. Os procedimentos adotados pela EMA para avaliar os alertas do fabricante no PSUR precisam ser revistos. O Controlador Geral de Medicamentos da Índia aceita quase automaticamente medicamentos e vacinas aprovados pela EMA. É necessário revisar a confiança na diligência da EMA.
Introdução
Em 23 de outubro de 2000, a comercialização de duas vacinas hexavalentes, Infanrix hexa® (GlaxoSmithKline plc-GSK) e Hexavac® (Sanofi Pasteur MSD, SNC), que combinam difteria, tétano, coqueluche acelular, hepatite B, la poliomielite inativada e influenza Haemophilus tipo B foram autorizadas na União Europeia. Após a autorização, houve vários relatos espontâneos de morte súbita inesperada imediatamente após a administração dessas vacinas hexavalentes. Em 2005, von Kries e colegas (1) realizaram uma análise detalhada na qual compararam as mortes observadas imediatamente após a vacinação com as baixas esperadas. Eles descobriram que a taxa de mortalidade padronizada (SMR) dentro de dois dias da vacinação com Hexavac havia aumentado significativamente em crianças vacinadas no segundo ano de vida.
Este não foi o caso do Infanrix Hexa. A pedido do titular da autorização de introdução no mercado, o Hexavac foi retirado em 2005 e o Infanrix Hexa continuou a ser comercializado na Europa (2). De acordo com a legislação europeia, a Agência Europeia de Medicamentos (EMA) é responsável por proteger a saúde pública por meio da avaliação de medicamentos aprovados por ela como autoridades reguladoras. Os fabricantes são responsáveis pela eficácia, qualidade e segurança de seus medicamentos (3).
O tribunal do juiz italiano Nicola Di Leo disponibilizou ao público os relatórios periódicos confidenciais de atualização de segurança (PSUR) 15 e 16a de 2009 a 2011 da GlaxoSmithKline (4). O PSUR 19 (que incorpora o PSUR 17, 18 e 19, de 15 de janeiro de 2015) foi obtido por um pesquisador italiano da EMA, em conformidade com o artigo 3 das regras da EMA (EMA 110196/2006 de 30 de novembro de 2010) (5) ). O médico italiano enviou esse PSUR ao primeiro autor (JP), pedindo que ele escrevesse um relatório a ser apresentado ao Parlamento Europeu. Este comentário é baseado em todos esses PSURs. No contexto do aspecto de segurança destacado anteriormente por von Kries (1), esse comentário examina a morte súbita após o uso da vacina Infanrix Hexa. Outros aspectos abordados no PSUR não são examinados.
PSUR 15 - agrupamento de mortos após a vacinação
A maioria das mortes que ocorrem no período pós-neonatal são devidas a infecções, defeitos congênitos, doenças malignas ou acidentes. As crianças raramente morrem sem uma causa óbvia e, portanto, as mortes são classificadas como (i) síndrome da morte súbita (SMSI), definida no PSUR como a morte que ocorre no primeiro ano de vida e permanece inexplicável após a autópsia, ou (ii) ) morte súbita inesperada (SUL), definida como a morte que ocorre nos primeiros dois anos de vida e que permanece inexplicável após a história clínica e final dos eventos, mas sem uma autópsia. Juntos, esses dois são considerados morte súbita (DS) no PSUR 15. Um certo número de vacinas é administrado a crianças menores de 2 anos em um determinado dia, e o número de crianças vacinadas em todo o mundo é muito grande. É possível que algumas crianças vacinadas possam morrer acidentalmente por SMSL / SUL, tais eventos teriam ocorrido mesmo se essas crianças não tivessem sido vacinadas naquele dia. Para verificar se tal morte foi causada pela vacinação ou foi um evento incidental, é realizada uma análise de SD observada / esperada. A análise avalia se o número de mortes observadas após a vacinação excede o que pode ser previsto por acaso.
Mortes súbitas: observadas em relação às expectativas
O PSUR 15 explica como essa análise foi realizada (4: p 782): "A Sociedade avaliou se o número de mortes súbitas relatadas nessa faixa etária que ultrapassou o número um poderia ocorrer aleatoriamente. Visto que a distribuição por idade quando os indivíduos foram vacinados é desconhecido, a empresa presumiu que a proporção de eventos adversos por idade é representativa da distribuição real por idade na vacinação. Portanto, pode-se estimar que 90,6% de todos os receptores de Infanrix Hexa estava no primeiro ano de vida e 9,4% no segundo ano de vida, portanto o número de doses (desde o lançamento) foi estimado em 54.927.729 e 5,698,904, respectivamente. Dado que a Alemanha é a principal país onde as doses de Infanrix Hexa são distribuídas (quase 30% somente na Alemanha), a incidência de morte súbita observada na Alemanha foi considerada representativa de toda a população receptora de Infanrix Hexa (Escritório FederalEstatísticas alemãs, Statistisches Bundesamt; taxa de incidência no primeiro ano de vida: 0,454 / 1000 nascidos vivos; segundo ano: 0.062 / 1000 nascidos vivos, dados de 2008).
"O PSUR documenta a morte relatada dentro de 20 dias após a vacinação. O número de mortes observadas foi menor que o esperado (tabela 1).
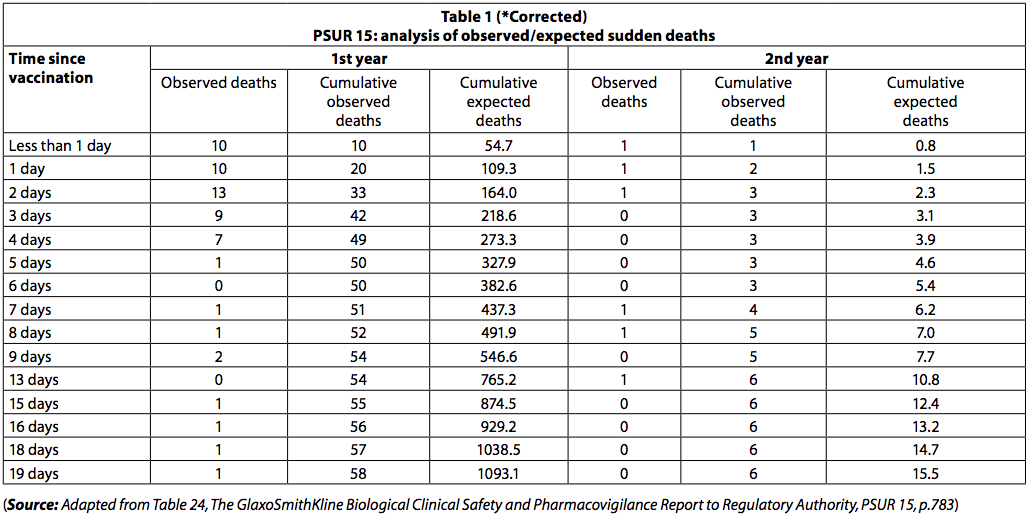
No entanto, entre os recém-nascidos, houve um agrupamento de mortes imediatamente após a vacinação, com 42 mortes ocorrendo nos primeiros três dias após a vacinação e apenas 8 nos próximos 3 dias. Entre os menores de um ano, 54 óbitos (93%) ocorreram nos primeiros dez dias e 4 (7%) nos 10 dias seguintes. Se as mortes tivessem sido "mortes aleatórias por SIDS", esta disparidade no número de mortes ao longo dos dois períodos de tempo não teria sido observada.
As mortes por SMSI teriam sido distribuídas igualmente durante o período de 20 dias.
O fato de a taxa de mortalidade cair rapidamente com o passar do tempo após a imunização sugere que as mortes podem estar relacionadas à vacinação.
Da mesma forma, entre as crianças com mais de um ano, 5 mortes (83,3%) ocorreram nos primeiros 10 dias e uma morte (17%) ocorreu nos 10 dias seguintes. O agrupamento de mortes relatadas no PSUR 15 também foi observado no PSUR 16, e isso foi comentado anteriormente (6).
Resposta da GlaxoSmithKline
Em resposta a esta crítica (7), GlaxoSmithKline (GSK) Chief Executive Officer (CEO) Sir Andrew Witty, através do Dr. Norman Begg, Chief Medical Officer da empresa, sugeriu em uma carta que é muito mais provável pensar em uma associação causal potencial e, em seguida, relatar um evento adverso à GSK se ocorrer logo após a vacinação, em vez de semanas depois. Ele escreveu ainda: "À luz do que precede, continuamos confiantes nas conclusões anteriormente alcançadas pela GSK e compartilhadas com agências regulatórias e autoridades de saúde em todo o mundo, de que os dados atualmente disponíveis não sugerem um aumento do risco de morte súbita infantil após vacinação com Infanrix hexa. Se os dados e informações disponíveis mudarem e sugerirem que existe um risco aumentado, continuamos empenhados em notificar imediatamente as autoridades e tomar as medidas necessárias para comunicar esses dados e informações aos profissionais de saúde. "
Esta resposta contém uma admissão tácita de que não houve vigilância ativa durante o período pós-vacinação e apenas as mortes espontaneamente relatadas à GSK foram incluídas no título "mortes observadas". Isso pode causar uma subestimação das mortes após a vacinação. Note-se que o número de doses distribuídas de vacina é usado para "mortes esperadas". O relatório reconhece que todas as doses da vacina distribuída não foram necessariamente usadas. Dessa forma, o número de "mortes esperadas" foi inflado.
No entanto, dada a explicação e a garantia do CEO de que a GSK se comprometeu a notificar imediatamente as autoridades e os profissionais de saúde sobre qualquer risco aumentado com o Infanrix Hexa, a questão do agrupamento de mortes não foi mais investigada.
PSUR 16: duplicação das mortes esperadas
Se todas as crianças que receberam a primeira dose da vacina receberem um total de quatro doses e a última dose for administrada no segundo ano de vida, pode-se estimar que 25% das doses são administradas a crianças mais velhas a um ano. Este é o esquema de vacinação recomendado na Alemanha. No entanto, alguns países, como a Itália, recomendam apenas três doses, todas no primeiro ano e nenhuma no segundo. Além disso, nem todas as crianças recebem todas as doses recomendadas. Portanto, é improvável que 20-25% das doses sejam usadas no segundo ano. No PSUR 15, estimou-se que 90,6% das doses vendidas foram utilizadas em lactentes com menos de um ano de idade e 9,4% para aqueles com mais de um ano de idade. No PSUR 16, a estimativa das doses recebidas no segundo ano mais do que dobrou (de 9,4% para 20%) e, portanto, a estimativa das mortes esperadas dobrou. Apesar da duplicação das mortes esperadas, o número de mortes observadas no segundo ano foi superior ao esperado nos primeiros 3 dias após a vacinação (Tabela 36, p249). Se a estimativa no PSUR 15 de que 9,4% das doses são usadas no segundo ano estiver correta, isso também se aplica ao PSUR 16 e, portanto, as mortes observadas são mais altas do que as esperadas nos primeiros 7 dias.
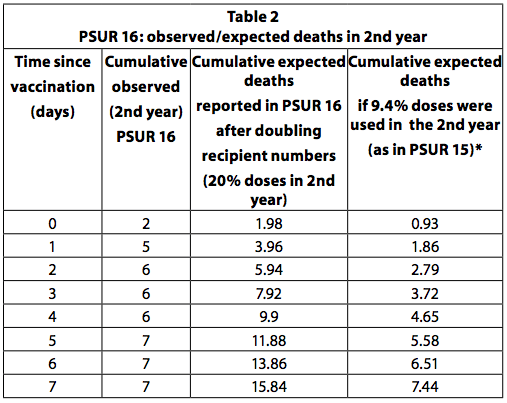
PSUR 19: mortes previstas ponderadas por país e proporção anual de doses
No PSUR 19, uma média ponderada do calendário das taxas de incidência de mortes súbitas na Alemanha, França e Holanda foi calculada para chegar à incidência esperada de mortes súbitas.
Em termos muito simples, isso significa que, se 60% das doses foram distribuídas na Alemanha em um determinado ano, a taxa de DP (morte súbita) na Alemanha recebeu um peso de 60% no cálculo da taxa de DP. geral para esse ano; se 30% foi distribuído na França, a taxa de SD na França contribuiu com 30% e o peso de 10% foi atribuído à taxa de SD holandesa. Finalmente, a taxa global de DP foi calculada para todos os anos juntos.
A taxa geral de DP foi calculada como 0.0102 / 1000 nascidos vivos para o segundo ano. Este número é um sexto da frequência esperada usada no PSUR 15 e 16 (que calculou mortes súbitas em 0,062 / 1000 nascidos vivos, usando dados alemães).
O intervalo de confiança de Poisson (IC) de 95% das mortes observadas no segundo ano é relatado na tabela 8 ap 447 do PSUR 19. É relatado que, no segundo ano de vida, o número de mortes observadas foi maior, também se não significativamente, que o das mortes esperadas dentro de um período de risco de 1-4 dias após a vacinação.
Mortes desaparecidas no PSUR 19
Do PSUR 16 ao PSUR 19, as doses totais da vacina aumentaram de 69 para 112 milhões. De acordo com o PSUR 19, foi assumido que 20,2% das doses distribuídas foram administradas a crianças no segundo ano de vida (PSUR 19, pp 436-448). Foram excluídos os casos de óbito em que a idade da vacinação não era conhecida, a data do óbito não foi registrada ou o tempo do óbito ultrapassou 19 dias após a vacinação.
O PSUR 19 (óbitos até 22 de outubro de 2014) não relata as mortes súbitas mencionadas no PSUR 16 (casos de óbito que ocorreram até 22 de outubro de 2011). Deve-se notar que no PSUR 16 foram registradas a idade da criança que morreu após a vacinação e a hora da morte (dentro de 14 dias da vacinação).
As mortes acumuladas relatadas são mais baixas no PSUR 19 do que no PSUR 16. Quanto às crianças acima de um ano, o PSUR 19 registra a ocorrência de apenas 5 mortes nos primeiros 19 dias após a vacinação, enquanto o PSUR 16 relata 8. Os números não são consistentes entre si. Nós nos perguntamos por que isso é assim.
Dez anos após a publicação do artigo do CDC (Center for Disease Control) examinando a relação entre a vacina contra sarampo, caxumba e rubéola (MMR) e autismo (8), um dos autores, William Thompson, admitiu que ele e seus coautores não conseguiram mostrar informações estatisticamente significativas de que homens afro-americanos que receberam MMR antes dos 36 meses de idade tinham um risco aumentado de autismo (9). Os autores apagaram os dados das crianças que não tinham certidão de nascimento na Geórgia (10), a fim de excluir um número desproporcional de crianças negras, e apresentaram seus dados para mostrar que não houve aumento na risco.
Não está claro se os autores do PSUR 19 também descartaram crianças mortas e documentadas no PSUR 16.
A Tabela 3 apresenta as mortes observadas e esperadas relatadas no PSUR 19 e as mortes observadas após a restauração das mortes relatadas no PSUR 16.
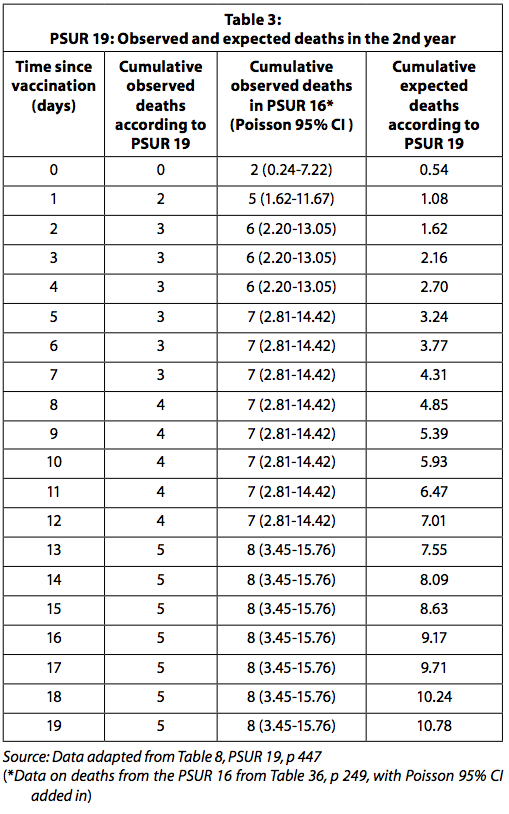
Quando os dados de óbitos observados no PSUR 16 são usados, o número de óbitos observados é significativamente maior do que o esperado para os primeiros quatro dias após a vacinação. Deve-se ter em mente, conforme explicado acima, que, como o número de óbitos observados é coletado passivamente, é provável que seja subestimado. As mortes esperadas, por outro lado, são provavelmente superestimadas, pois são calculadas com a suposição de que todas as doses distribuídas foram usadas sem qualquer perda e nenhuma vacina foi descartada porque ela expirou. Esperava-se que a GSK relatasse à autoridade regulatória e aos médicos o aumento estatisticamente significativo do risco de morte nos quatro dias após a vacinação.
As doses utilizadas no segundo ano
O PSUR 19 assume que 20,2% das doses foram usadas no segundo ano. Ele afirma que a distribuição da idade em que os indivíduos são vacinados é desconhecida e a empresa especulou que a proporção de eventos adversos (incluindo morte) por idade é representativa da distribuição etária real na vacinação. Assim, como 20,2% dos eventos adversos ocorreram em crianças acima de um ano de idade, a empresa assumiu que 20,2% das doses foram utilizadas para essa faixa etária.
É fácil estimar o número de doses usadas no segundo ano com base nos eventos adversos observados (incluindo a morte), use essa estimativa de dose para calcular o número de mortes esperadas e, finalmente, compará-la com o número de mortes observadas - considerando que o A estimativa de mortes esperadas é calculada principalmente a partir dos eventos negativos observados (incluindo a morte).
Assumindo que todas as mortes após a vacinação são coincidentes e não causais, SIDS / SUD estão relacionadas à vacina, e considerando que (de acordo com o PSUR 19) a frequência natural de morte súbita no primeiro ano é 44 vezes maior que no segundo ano (0.441 / 1000 no primeiro ano e 0.0102 / 1000 no segundo ano), 44 vezes mais crianças devem ser vacinadas no segundo ano para atingir o mesmo número de mortes que no primeiro ano.
Em uma coorte de 100 mortes, se 20% das mortes súbitas ocorrem no segundo ano e 80% no primeiro ano, 880 crianças devem ser vacinadas no segundo ano para cada 20 vacinadas no primeiro ano. Nesse caso, seria assumido que 44% de todas as doses de Infanrix hexa teriam sido usadas no segundo ano e apenas 80% no primeiro ano (em vez do contrário). Isso reflete o absurdo de calcular a distribuição de doses por idade, com base na distribuição etária de eventos adversos, conforme feito no documento GSK.
A única maneira de avaliar o número de doses usadas no segundo ano é observar os horários de vacinação em diferentes países - observando quais países recomendam a quarta dose no segundo ano e quais não recomendam as doses no segundo ano. Pode ser atribuído um peso para o número de doses distribuídas nesses países. A taxa de abandono escolar (crianças que abandonam o programa de vacinação após receber as primeiras doses da vacina) também deve ser considerada no cálculo final da porcentagem de doses utilizadas no segundo ano. Parece que uma estimativa razoável das doses usadas no segundo ano é de 9,4% das doses totais e esse é o valor usado no PSUR 15.
O dilema ético - o problema do carrinho
Este comentário não tenta examinar se essas mortes excessivas após a vacinação (presumivelmente causadas pela vacina) podem ser compensadas pelas vidas salvas pela doença com a prevenção obtida com a vacina. Em seu experimento mental clássico, chamado dilema do carrinho, Philippa Foot pergunta se é ético redirecionar um carrinho que escapou de uma via férrea que mataria cinco pessoas em outra via, onde apenas uma teria morrido (11). . Em uma variante do dilema do carrinho, a única pessoa na pista alternativa é a filha da pessoa que pode mudar de pista.[2] Judith Thomson assume que cinco vidas podem ser salvas por transplantes de órgãos de um doador saudável e pergunta se seria ético matar intencionalmente uma pessoa para salvar as outras cinco (12). A ética argumenta que o fim não pode justificar os meios. Se você ocultar a morte após a vacinação, poderá impedir / atrasar a avaliação do perfil de segurança da vacina e isso pode causar mais mortes desnecessárias, difíceis de justificar eticamente.
Relevância para a Índia
A autoridade reguladora do governo da Índia é o Controlador Geral de Drogas da Índia (DCGI). De acordo com as regras do DCGI, os medicamentos aprovados em um ou mais países, como Estados Unidos, Reino Unido, Canadá, Japão, Austrália e países da União Européia, também são aprovados na Índia (13). Apenas estudos adicionais são necessários para avaliar o impacto de fatores étnicos nos esquemas de eficácia, segurança, dosagem e dosagem de medicamentos (14).
Recentemente, estudos examinando a imunogenicidade e segurança da vacina combinada hexavalente em pequenos ensaios foram publicados na Índia (15,16). Além disso, a Indian Pediatrics publicou um editorial intitulado "Hexavalent Vaccinations: The Future of Routine Immunization?" (17), que sugeriu que essa vacina combinada seria promovida na Índia. É vital que a autoridade reguladora na Índia esteja ciente das preocupações levantadas neste comentário sobre os relatórios do PSUR, especialmente porque os sistemas de vigilância na Índia são fracos.
Resumo e conclusão
Von Kries (1) relatou um aumento estatisticamente significativo na SMR em crianças no segundo ano de vida, dentro de dois dias da vacinação com Hexavac® (uma das duas vacinas hexavalentes autorizadas, agora retiradas).
Nos relatórios periódicos de atualização de segurança, a GSK, empresa produtora da Infanrix hexa, avalia se o número de mortes repentinas relatadas após a vacinação com seu medicamento excedeu o número esperado por acaso. O agrupamento de mortes imediatamente após a imunização sugere que a morte pode ter sido causada pela vacina.
Além disso, nossa análise mostra que as mortes reconhecidas no PSUR 16 foram eliminadas do PSUR 19. As mortes observadas são relatadas espontaneamente à GSK e provavelmente serão subestimadas. Ao adicionar mortes apuradas no PSUR 16, há um aumento estatisticamente significativo no risco de morte nos primeiros quatro dias após a vacinação, em comparação com as mortes esperadas. Os fabricantes precisarão explicar por que essas mortes não foram incluídas no PSUR 19. O risco aumentado de morte não foi divulgado à autoridade reguladora ou ao pessoal de saúde que administrava esta vacina.
Diante do exposto, é difícil entender como a EMA pode ter aceito o PSUR 19 de maneira nominal. Pode-se argumentar que a devida diligência não foi exercida, de modo que muitas crianças foram expostas desnecessariamente ao risco de morte.
O DCGI deve estar ciente das limitações do Infanrix Hexa PSUR.

