Может ли пневмококковая вакцина вызвать травму и/или смерть?

ВАЖНАЯ ЗАМЕТКА: Corvelva предлагает вам получить подробную информацию, прочитав все разделы и ссылки, а также листовки производителя и технические описания, а также поговорить с одним или несколькими доверенными специалистами, прежде чем принять решение о вакцинации себя или своего ребенка. Эта информация предназначена только для информационных целей и не предназначена в качестве медицинской консультации.
Проблема множественных вакцин (нажмите, чтобы открыть)
Проблема множественных вакцин

Текущие календари прививок, особенно для детского возраста, предусматривают введение нескольких антигенов и вакцин за один сеанс, что способствует комфорту в ущерб безопасности. Для того, чтобы иметь возможность произнести конкретную речь о безопасности вакцин, мы обязательно должны учитывать сложность явления, советуя всем читателям адекватно осведомляться обо всех аспектах вакцинации, плюсах и минусах.
Доктор Рассел Блейлок, клинический доцент нейрохирургии в Медицинском центре Университета Миссисипи, много лет изучал «токсическую синергию» и смог наблюдать, что когда два слаботоксичных пестицида, ни один из которых не способен вызвать синдром Паркинсона у экспериментальных животных, сочетаются друг с другом, могут вызвать заболевание даже быстро, и сравнивает это явление с явлением, когда несколько вакцин вводятся одновременно: «Прививки, если их слишком много и слишком близко друг к другу, ведут себя как хроническое заболевание».(A). Другие Два исследования подтвердили, что внезапная младенческая смерть может наступить после однократного введения нескольких вакцин.(до н.э)
Исследование, опубликованное в журнале Human and Experimental Toxicology, показало, что страны, которые назначают больше вакцин детям, как правило, имеют более высокий уровень младенческой смертности.(D) Например, в США, где дети получают 26 вакцин, умирает более 6 детей на 1000 живорождений, а в Швеции и Японии, где вводится 12 педиатрических вакцин, на каждую 3 живорождений приходится 1000 смерти. В вышеупомянутом исследовании также рассматривается связь между вакцинами и СВДС.
Из швейцарского исследования, опубликованного в 2005 году в Европейском журнале педиатрии.(Е) получается, что, что касается воздействия на недоношенных детей, частота повторного или усиленного апноэ и брадикардии после введения шестивалентных вакцин составляет 13%. В том же году в том же журнале было опубликовано немецкое исследование, в котором изучалась внезапная смерть младенцев после шестивалентного отравления. Авторы пишут: «Эти результаты, основанные на спонтанных сообщениях, не доказывают причинно-следственной связи между вакцинацией и внезапной младенческой смертью, но представляют собой сигнал относительно одного из двух имеющихся шестивалентников; сигнал, который должен привести к усилению эпиднадзора за внезапными младенческими смертями после вакцинации».(F)
В 2006 году она была опубликована в медицинском журнале Vaccine.(Г) письмо от группы исследователей из Мюнхенского университета, в котором сообщается о «шести случаях внезапной детской смерти после шестивалентной вакцинации. Все найдены мертвыми без объяснения причин через 1-2 дня после вакцинации». Они были классифицированы как типичные случаи внезапной детской смерти, но аутооптическая верификация выявила нейропатологические и гистологические отклонения, и у всех детей наблюдался значительный отек головного мозга, что делало их исключением по сравнению с другими случаями СВДС.синдром внезапной детской смерти). Исследователи писали, что «До введения шестивалентной вакцины (в 1994-2000 годах) мы наблюдали случай внезапной младенческой смерти только у одного из 198 детей, который умер вскоре после прививки АКДС. Но в период с 2001 по 2004 год они выявили пять подобных случаев из 74 случаев СВДС. Это будет означать тринадцатикратное увеличение».
Также в 2006 г. в архиве Вирхова.(H), группа из Института патологии Миланского университета написала: «Эксперты Европейского агентства по оценке медицинских продуктов проанализировали возможность того, что между шестивалентными вакцинами и некоторыми случаями смерти может быть связь. В число участников входили патологоанатомы с опытом работы с вакцинами и синдромом внезапной детской смерти, проводившие вскрытия, но, насколько нам известно, исследованию ствола мозга и кровяного сердца на серийных срезах уделялось мало внимания и не было возможности установить триггерную роль вакцины от этих смертей. Здесь мы сообщаем о случае внезапной смерти 3-месячной девочки после шестивалентной вакцинации. При исследовании ствола головного мозга на серийных срезах выявлена двусторонняя гипоплазия аркуатных ядер. Проводящая система сердца имела стойкую фетальную дисперсию и дистрофию. Этот случай предлагает уникальное понимание возможной роли шестивалентной вакцины в летальных последствиях для уязвимого ребенка. В любом случае внезапной и неожиданной смерти, наступившей вскоре после рождения или в раннем детстве, особенно после вакцинации, всегда следует проводить полное вскрытие в соответствии с рекомендациями.
Ссылки
- Блейлок Р., «Прививки: скрытые опасности», Отчет о состоянии здоровья Блейлока, май 2004 г., стр. 1–9.
- Оттавиани Г. и др., «Синдром внезапной детской смерти (СВДС) вскоре после шестивалентной вакцинации: еще одна патология при подозрении на СВДС?», Вирхов Архив., 2006, 448, с. 100-104.
- Зинка Б. и др., «Необъяснимые случаи внезапной детской смерти вскоре после шестивалентной вакцинации», Вакцина, июль 2006 г., 24 (31-32), стр. 5779-5780.
- Миллер Н.З. и др.1. , "Показатели младенческой смертности регрессировали в зависимости от количества рутинно вводимых доз вакцины: есть ли биохимическая или синергетическая токсичность?», Hum. Exp. Toxicol., May 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
Проблема с алюминием (нажмите, чтобы открыть)
Алюминий в вакцинах: что нужно знать родителям

1. Что такое алюминий?
Алюминий — легкий металл серебристо-белого цвета, ковкий и прочный. Эти качества делают его полезным во многих отраслях и продуктах, включая машины, строительство, склады, посуду, кухонную утварь, текстиль, красители и косметику. Алюминий также является самым распространенным металлом в земной коре, и практически весь алюминий в окружающей среде содержится в почве. Однако в естественных условиях алюминий не содержится в значительных количествах в живых организмах (таких как растения и животные) и не имеет известной биологической функции. За последнее столетие использование алюминия в некоторых продуктах привело к увеличению воздействия на человека. Основными источниками воздействия являются продукты, содержащие алюминий (например, разрыхлители, полуфабрикаты, детские смеси и т. д.), медицинские продукты (например, антиперспиранты, антациды и т. д.), инъекции от аллергии и вакцины.1-3
2. Почему алюминий присутствует в вакцинах?
В некоторых вакцинах в качестве адъювантов используются соединения алюминия (гидроксид алюминия и фосфат алюминия), которые являются ингредиентами, усиливающими иммунный ответ на антиген (чужеродное вещество).4-5 Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) заявляет, что если некоторые вакцины не будут содержать алюминий, иммунный ответ, который они вызывают, может снизиться.6
3. Какие вакцины содержат алюминий?
Следующие вакцины содержат алюминий и вводятся младенцам, детям и подросткам (рис. 1):
- Гепатит В (HepB)
- шестивалентный
- Дифтерия, столбняк и коклюш (DTaP и Tdap)
- Haemophilus influenzae типа b (PedvaxHIB)
- Пневмококк (ЦВС)
- Гепатит А (HepA)
- Вирус папилломы человека (ВПЧ)
- Менингококк В (MenB)
Рисунок 1: До 18 доз вакцин, содержащих алюминий, вводят от рождения до 22 лет.7-8
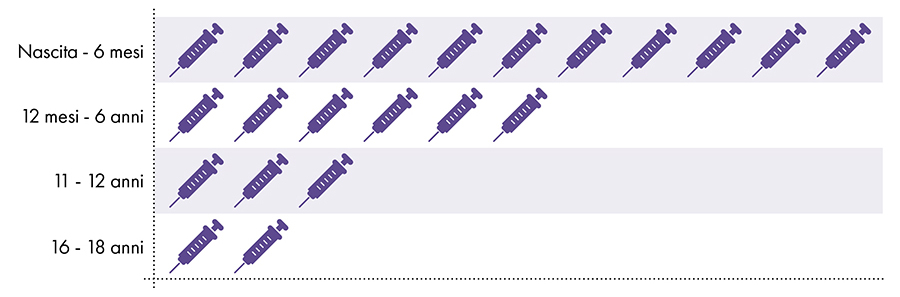
4. Безопасно ли воздействие алюминия?
FDA считает алюминий общепризнанным безопасным (GRAS) с 1975 года.9 Однако до 1990 года не существовало технологий для точного определения небольших количеств алюминия, вводимых субъектам в научных исследованиях.10 Следовательно, количество алюминия, которое могло абсорбироваться до появления побочных эффектов, было неизвестно.
С 1990-х годов благодаря техническим достижениям было замечено, что небольшие количества алюминия, остающиеся в организме человека, нарушают ряд клеточных и метаболических процессов в нервной системе и тканях других частей тела.1-10-11 Наибольшие негативные эффекты алюминия наблюдаются в нервной системе и варьируются от нарушения двигательных навыков до энцефалопатии (изменение психического статуса, изменения личности, трудности мышления, потеря памяти, судороги, кома и др.).2-12
Министерство здравоохранения и социальных служб США (HHS) признает алюминий известным нейротоксином.2 Кроме того, FDA предупредило о рисках токсичности алюминия у младенцев и детей.13
ФЕДЕРАЛЬНЫЙ РЕГИСТР: Ежедневная газета правительства США.«Даже доношенные дети с нормальной функцией почек могут подвергаться риску из-за быстрого роста и незрелости мозга и скелета, а также незрелости гематоэнцефалического барьера. скорости клубочковой фильтрации, чем у взрослых, что влияет на их функцию почек.Агентство опасается, что маленькие дети и люди с незрелой функцией почек подвергаются повышенному риску воздействия алюминия». |
5. Насколько пероральный алюминий небезопасен?
В 2008 году Агентство по регистрации токсических веществ и заболеваний (ATSDR), подразделение HHS, использовало исследования нейротоксического действия алюминия, чтобы определить, что не более 1 миллиграмма (1.000 микрограммов) алюминия на килограмм веса тела в день для избежать негативного воздействия алюминия.2
6. Какое количество введенного алюминия небезопасно?
Чтобы определить количество алюминия, которое можно безопасно вводить инъекционно, необходимо преобразовать пероральный предел алюминия ATSDR. Предел ATSDR для перорального алюминия (1.000 мкг алюминия на килограмм массы тела в день) основан на 0,1% перорального алюминия, который всасывается в кровоток, поскольку пищеварительный тракт блокирует почти весь пероральный алюминий.2 Напротив, алюминий, введенный внутримышечно, не проходит через желудочно-кишечный тракт, и 100% алюминия со временем может всосаться в кровоток (т. е. доля абсорбированного алюминия в 1.000 раз выше). Чтобы учесть эти различные количества абсорбции, предел алюминия для перорального приема в ATSDR необходимо разделить на 1000. Это преобразование приводит к полученному из ATSDR пределу алюминия в крови, равному 1 мкг алюминия (0,1% от 1.000 мкг) на килограмм массы тела. в день. Следовательно, чтобы избежать нейротоксического действия алюминия, ежедневно в кровоток должно поступать не более 1 мкг алюминия на килограмм массы тела. На рисунке 3 показан предельный уровень алюминия в крови, полученный с помощью ATSDR, для младенцев разного возраста в зависимости от их веса.
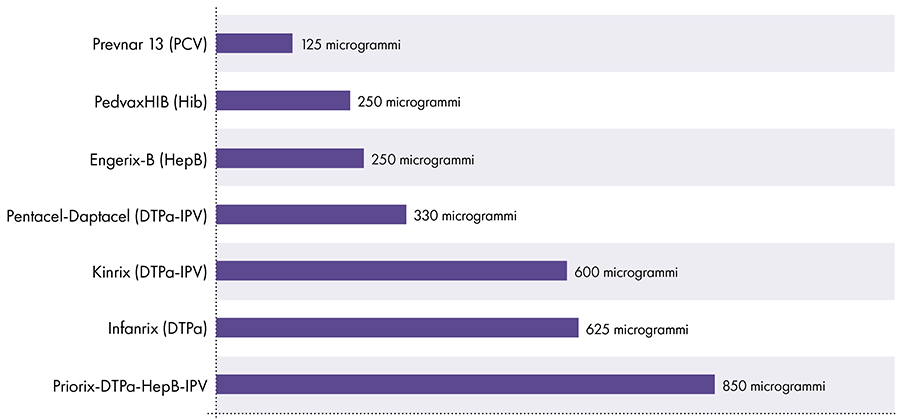
7. Сколько алюминия содержится в вакцинах?
Количество алюминия в вакцинах варьируется.16 В 1968 году федеральное правительство США установило предел содержания алюминия в вакцинах на уровне 850 мкг на дозу, исходя из количества алюминия, необходимого для обеспечения эффективности некоторых вакцин.6-17 Следовательно, количество алюминия в алюминийсодержащих детских вакцинах колеблется от 125 до 850 мкг на дозу. На рис. 4 показано содержание алюминия в одной дозе различных вакцин, вводимых детям.
8. Проводились ли какие-либо исследования по сравнению количества алюминия в вакцинах с пределом, установленным Агентством по регистрации токсичных веществ и заболеваний (ATSDR)?
В 2011 году было опубликовано исследование, целью которого было сравнить количество алюминия в вакцинах с пределом кровотока, установленным ATSDR.18 Однако это исследование неправильно основывало свои расчеты на 0,78% перорального поступления алюминия в кровоток, а не на значении 0,1%, используемом в расчетах ATSDR.19-20 В результате исследование 2011 года выдвинуло гипотезу о том, что почти в 8 раз (0,78% / 0,1%) алюминий может безопасно попасть в кровоток, и это привело к неверному выводу.
9. Безопасно ли воздействие алюминия из вакцин?
Вакцины вводят внутримышечно, и скорость, с которой алюминий из вакцин мигрирует из мышц человека в кровоток, неизвестна. Исследования на животных показывают, что попадание алюминия из вакцин в кровоток может занять от пары месяцев до более года из-за множества переменных.21-23 Поскольку кумулятивное воздействие алюминия из вакцин у детей в возрасте до одного года превышает дневной лимит, установленный ATSDR, на несколько сотен (рис. 3 и 4), предел все равно будет превышен, если алюминий из вакцин попадет в кровоток в течение курса лечения. около года. Кроме того, некоторые исследования показали, что алюминий из вакцин поглощается иммунными клетками и достигает частей тела, удаленных от места инъекции, включая мозг.24
Степень неблагоприятного воздействия алюминия в вакцинах неизвестна, поскольку исследования безопасности не проводились, сравнивая население, вакцинированное алюминийсодержащими вакцинами, с населением, не вакцинированным такими вакцинами.
Алюминиевое ограничение кровотока, полученное из ATSDR2-14-15
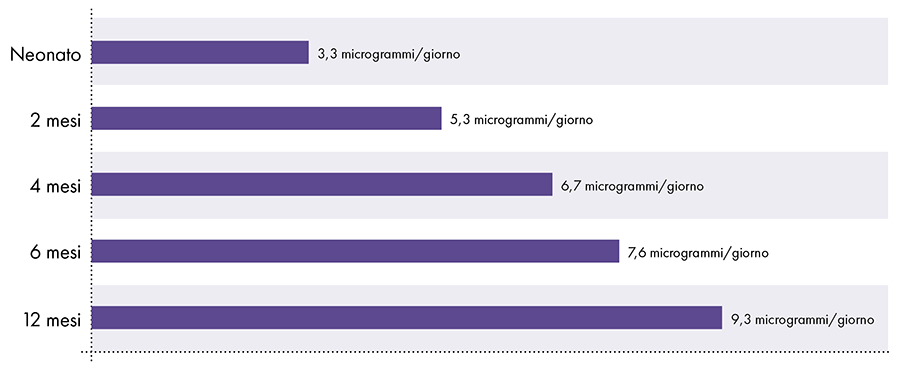 Рисунок 3: На этом графике показано предельное содержание алюминия для детей разного возраста, полученное из Реестра токсичных веществ и заболеваний, подразделения Министерства здравоохранения и социальных служб США. Ограничение указывает на то, что не более 1 микрограмма алюминия на килограмм веса тела должно ежедневно попадать в кровоток, чтобы избежать нейротоксического действия алюминия.
Рисунок 3: На этом графике показано предельное содержание алюминия для детей разного возраста, полученное из Реестра токсичных веществ и заболеваний, подразделения Министерства здравоохранения и социальных служб США. Ограничение указывает на то, что не более 1 микрограмма алюминия на килограмм веса тела должно ежедневно попадать в кровоток, чтобы избежать нейротоксического действия алюминия.
Количество алюминия в вакцинах
Ссылки
- Американская академия педиатрии, Комитет по питанию. Токсичность алюминия у младенцев и детей. Педиатрия. 1996 март; 97 (3): 413.
- Агентство регистрации токсичных веществ и заболеваний (ATSDR). Токсикологический профиль алюминия. Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб США; 2008.3, 13-24, 145, 171-7, 208.
- Йокель РА. Алюминий в продуктах питания — природа и вклад пищевых добавок. В: Эль-Самраги Й, редактор. Пищевая добавка. Риека (Хорватия): InTech; 2012. 203-28.
- Маррак П., Макки А.С., Манкс М.В. К пониманию адъювантного действия алюминия. Нат Рев Иммунол. 2009 апр; 9 (4): 287.
- Волк В.К., Банни В.Е. Иммунизация дифтерии жидким анатоксином и квасцовым анатоксином. Am J Общественное здравоохранение Здоровье наций. 1942 июль, 32 (7): 690-9.
- Бэйлор Н.В., Иган В., Ричман П. Соли алюминия в вакцинах — точка зрения США. вакцина. 2002 г., 31 мая, 20 Приложение 3: S18-22.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Silver Spring (MD): Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Вакцины, лицензированные для использования в США; [обновлено 2018 февраля 14 г .; цитируется 2018 февраля 27 г.]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Центры по контролю и профилактике заболеваний. Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб США. Рекомендуемый график прививок для детей и подростков в возрасте 18 лет и младше, США, 2018 г. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Silver Spring (MD): Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. SCOGS (Специальный комитет по веществам GRAS); [цитировано 2018 августа 16 г.]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Священник Н.Д. Биологическое поведение и биодоступность алюминия у человека с особой ссылкой на исследования с использованием алюминия-26 в качестве индикатора: обзор и обновление исследования. J Мониторинг окружающей среды. 2004, 6: 376,392.
- Пул Р.Л., Пьерони К.П., Гаскари С., Диксон Т.К., Парк К.Т., Кернер Дж.А. Алюминий в педиатрических продуктах для парентерального питания: измеренное содержание в сравнении с указанным на этикетке. J Pediatr Pharmacol Ther. 2011, 16 (2): 92-7.
- Седман А. Токсичность алюминия в детском возрасте. Педиатр Нефрол. 1992 июль, 6 (4): 383-93.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Министерство здравоохранения и социальных служб. Правила и положения. Реестр ФРС. 2003 июнь; 68 (100): 34286.
- Центры по контролю и профилактике заболеваний. Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб США. Национальный центр медицинской статистики: Таблица данных для мальчиков, диаграмм роста и веса по возрасту; [цитировано 2019 апреля 2 г.]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Центры по контролю и профилактике заболеваний. Вашингтон, округ Колумбия: Министерство здравоохранения и социальных служб США. Национальный центр статистики здравоохранения: Таблица данных для диаграмм роста и веса девочек по возрасту; [цитировано 2019 апреля 2 г.]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, Министерство здравоохранения и социальных служб. Пересмотр требований к составным материалам. Окончательное правило. Реестр ФРС. 2011 13 апреля, 76 (71): 20513-8.
- Управление Федерального реестра, Национальная служба архивов и документации, Управление общих служб. Правила и положения. Реестр ФРС. 1968 г., январь; 33 (6): 369.
- Миткус Р.Дж., Кинг Д.Б., Хесс М.А., Форши Р.А., Вальдерхауг М.О. Обновленная фармакокинетика алюминия после воздействия на младенцев через диету и вакцинацию. вакцина. 2011 28 ноября, 29 (51): 9538-43.
- Миллер С., Врачи за информированное согласие. Опечатка в «Обновленной фармакокинетике алюминия после воздействия на младенцев через диету и вакцинацию». В: ResearchGate. Берлин (Германия): ResearchGate GmbH; 2020 марта 6 г. [цитировано 2020 марта 6 г.]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Врачи за информированное согласие. Ньюпорт-Бич (Калифорния): Врачи за информированное согласие. Опечатка в «Обновленной фармакокинетике алюминия после воздействия на младенцев через диету и вакцинацию»; [цитировано 2020 марта 6 г.]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. Абсорбция алюминийсодержащих вакцинных адъювантов in vivo с использованием 26Al. Вакцина 1997, август-сентябрь, 15 (12-13): 1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Анализ алюминия и оценка местной реакции в несколько моментов времени после внутримышечного введения вакцин, содержащих алюминий, у обезьян Cynomolgus. вакцина. 2005 3 февраля, 23 (11): 1359-67.
- Вайссер К., Гён Т., Одуро Д.Д., Вангорш Г., Ханшманн К.О., Келлер-Станиславски Б. Алюминий в плазме и тканях после внутримышечной инъекции адъювантных человеческих вакцин крысам. Арх Токсикол. 2019 окт; 93 (10): 2787-96.
- Массон Д.Д., Крепо Г., Отье Ф.Дж., Эксли С., Герарди Р.К. Критический анализ эталонных исследований токсикокинетики адъювантов на основе алюминия. Дж. Инорг Биохим. 2018 Апрель; 181: 87-95.
Статью перевел Врачи за осознанное согласие
По данным Центра по контролю и профилактике заболеваний США, проблемы, которые могут возникнуть после вакцинации 13-валентной пневмококковой конъюгированной вакциной (PCV13), 23-валентной пневмококковой полисахаридной вакциной (PPSV23) и любыми другими вакцинами, включают:(1-2)
- Тяжелые аллергические реакции, возникающие в течение нескольких минут или часов после вакцинации.
- Сильная боль в плече, ограничивающая движения руки, в которой проводилось введение.
- Обморок или коллапс после вакцинации. Вам могут посоветовать оставаться сидя или лежать в течение примерно 15 минут после вакцинации, чтобы избежать обморока и травм, которые могут возникнуть в результате падения. Важно сообщить своему врачу, если после вакцинации у вас возникнет звон в ушах, изменение зрения или головокружение.
Побочные эффекты вакцины PCV13 (пневмококковая конъюгатная вакцина)
Побочные реакции после введения PCV13 варьируются в зависимости от дозы серии и возраста реципиента. У детей наиболее частыми реакциями были раздражительность, сонливость, потеря аппетита, покраснение, боль или отек в месте введения вакцины, а также легкая или умеренная лихорадка.
Дети, получившие PCV13 одновременно с инактивированной вакциной против гриппа, подвергались повышенному риску фебрильных судорог.
У взрослых сообщалось о покраснении, отеке и боли в месте инъекции, усталости, лихорадке, ознобе, головной и мышечной боли.(3)
Побочные реакции препарата Превенар 13 (PCV13), зарегистрированные у младенцев и детей в ходе предрегистрационных клинических исследований:(4) боль в месте инъекции, отек, покраснение, лихорадка, снижение аппетита, увеличение и уменьшение сна, раздражительность, диарея, рвота, сыпь, крапивница, реакции гиперчувствительности, включая бронхоспазм, отек лица и одышка, судороги, пневмония, гастроэнтерит, бронхиолит, смерть (зарегистрированная как СВДС).
Побочные реакции препарата Превенар 13 (PCV13), зарегистрированные у взрослых в ходе предрегистрационных клинических исследований:(5) боль, отек и покраснение в месте инъекции, ограничение движений рук, лихорадка, рвота, озноб, мышечная боль, утомляемость, головная боль, снижение аппетита, сыпь, боль в суставах, смерть (смерти, зарегистрированные в ходе доклинических исследований, включали смерти от рака , болезни сердца, перитонит, инфекция легких Mycobacterium avium complex и септический шок).
Побочные реакции Превенара 13 (PCV13), зарегистрированные в постмаркетинговый период:(6) Цианоз, лимфаденопатия в месте инъекции, анафилаксия, шок, гипотония, бледность, апноэ, ангионевротический отек, мультиформная эритема, зуд в месте инъекции, крапивница и сыпь.
Предварительные клинические испытания первой пневмококковой конъюгированной вакцины Превенар (PCV7), сравнили безопасность Превенара (PCV7) с экспериментальной вакциной против менингита С, что серьезно поставило под угрозу научную достоверность исследования.
В клинических исследованиях, предшествовавших разрешению Превенара (PCV7), дети в группах, получавших пневмококковую вакцину, больше страдали от судорог, раздражительности, высокой температуры и других реакций. В группе Превенара (PCV7) произошло 12 смертей, включая 5 смертей от синдрома внезапной детской смерти (СВДС). Не было проведено никаких долгосрочных исследований, чтобы оценить, связана ли вакцина Превенар (PCV7), применяемая отдельно или в сочетании с другими вакцинами, с хроническими заболеваниями или нарушениями, такими как развитие диабета, астмы, судорожных расстройств, трудностей в обучении. , СДВГ.(7)
В предрегистрационных клинических испытаниях вакцины «Превенар 13» (PCV13) эту вакцину нового поколения сравнивали с оригинальной вакциной «Превенар» (PCV7), безопасность которой не была должным образом изучена, и в 2012 году сообщалось о связи между фебрильными судорогами и Превенар 13 (PCV13).(8-9)
PCV13 был связан с повышенным риском фебрильных судорог при независимом введении.(10) и когда ее вводили в сочетании с парентеральной инактивированной гриппозной вакциной (IIV).(11)
Некоторые исследования также связали вакцину ЦВС с синдромом Гийена-Барре.(12) полисерозиту,(13) до септического плеча(14) и мультиформная эритема.(15)
Побочные эффекты вакцины PPSV23 (пневмококковая полисахаридная)
По данным CDC, примерно 50% людей, получивших пневмококковую полисахаридную вакцину (PPSV23), испытывают боль и покраснение в месте инъекции. После введения PPSV23 также могут возникнуть мышечная боль, лихорадка и более серьезные локализованные реакции.(16)
Побочные реакции PNEUMOVAX23 (PPSV23), зарегистрированные у взрослых в ходе предрегистрационных клинических исследований в США:(17) боль в месте инъекции, покраснение, зуд, синяки и отеки, головная боль, озноб, лихорадка, диарея, диспепсия, тошнота, инфекция верхних дыхательных путей, боль в спине, боль в шее, фарингит, мышечная боль, усталость, депрессия, язвенный колит, боль в груди, стенокардия, сердечная недостаточность, тремор, скованность движений, потливость, инсульт, поясничная радикулопатия, панкреатит, инфаркт миокарда, смерть.
Почти 80% субъектов, участвовавших в предрегистрационных клинических исследованиях, испытали нежелательную реакцию в месте инъекции после ревакцинации через три-пять лет после первоначальной вакцинации. Частота системных побочных реакций (головная боль, утомляемость, миалгия) после ревакцинации PPSV23 также была выше: о побочных реакциях сообщили 33% взрослых в возрасте 65 лет и старше и 37,5% взрослых в возрасте от 50 до 64 лет.(18)
Побочные реакции PNEUMOVAX23 (PPSV23), зарегистрированные в постмаркетинговый период:(19) Анафилактоидные реакции, сывороточная болезнь, ангионевротический отек, артрит, артралгия, рвота, тошнота, снижение подвижности конечностей, периферические отеки в инъецированной конечности, лихорадка, недомогание, целлюлит, повышение температуры в месте инъекции, лимфаденопатия, лимфаденит, лейкоцитоз, тромбоцитопения у больных с стабилизированная идиопатическая тромбоцитопеническая пурпура, гемолитическая анемия у пациентов с другими гематологическими нарушениями, парестезии, синдром Гийена-Барре, радикулоневропатия, фебрильные судороги, сыпь, мультиформная эритема, крапивница, целлюлитоподобные реакции.
Хотя PNEUMOVAX23 (PPSV23) одобрен для использования у детей в возрасте двух лет и старше с такими заболеваниями, как хронические заболевания сердца и легких, диабет, кохлеарные имплантаты, утечка спинномозговой жидкости, серповидно-клеточная анемия, функциональная или анатомическая аспления и иммуносупрессия. Во вкладыше к упаковке вакцины нет информации о безопасности и эффективности вакцины у детей.(20)
Некоторые исследования связали PPSV23 с системными воспалительными реакциями.(21) е февраль.(22-23-24-25-26)
Ссылки (нажмите, чтобы открыть)
- CDC Пневмококковый конъюгат (PCV13) VIS. 5 ноября 2015 г.
- CDC Пневмококковый полисахарид ВИС. Апреле 24, 2015
- CDC Пневмококковый конъюгат (PCV13) VIS. 5 ноября 2015 г.
- FDA Вкладыш в упаковку Превнара 13 Август 22, 2017
- Там же
- Там же
- FDA Пневмококковая 7-валентная конъюгированная вакцина (ПРЕВНАР) - вкладыш производителя продукта. 1 октября, 2002
- Хитт, Э. По мнению комиссии FDA, следует следить за приемом Превнара 13 из-за риска фебрильных судорог. Медскейп. 31 января, 2012
- Це А., Ценг Х.Ф., Грин С.К. и др. Идентификация сигналов и оценка риска фебрильных судорог у детей после применения трехвалентной инактивированной вакцины против гриппа в рамках Проекта передачи данных по безопасности вакцин, 2010–2011 гг. Вакцины. 2012 март 2;30(11):2024-31
- Бейкер М., Янкоски С., Йих К. и др. Риск фебрильных судорог после вакцинации против гриппа и 13-валентной пневмококковой конъюгатной вакцины. Открыть форум Infect Dis. 2017 Осень; 4 (Приложение 1): S464–S465.
- CDC Детские прививки и фебрильные судороги Июнь 20, 2016
- Равишанкар, Н. Синдром Гийена-Барре после вакцинации ПКВ. Джей Нейрол Нейрохирургия 4 (1): 134
- Тауфик П., Эли Гертнер Э., МакЭвой CE. Тяжелый полисерозит, вызванный 13-валентной конъюгированной пневмококковой вакциной: описание случая J Med Case Rep. 2017; 11: 142.
- ДеРогатис М.Дж., Парамесваран Л., Ли П. и др. Септический плечевой сустав после пневмококковой вакцинации, требующий хирургической обработки. HSS J. 2018 Oct;14(3):299-301
- Монастирли А., Пасматци Е., Бадаванис Г. и др. Мультиформная эритема после пневмококковой вакцинации. Акта Дерматовенерол Альп Панноника Адриат. 2017 Mar;26(1):25-26.
- CDC Пневмококковый полисахарид ВИС. Апреле 24, 2015
- FDA Пневмовакс 23 – пневмококковая вакцина, поливалентная. Вставка в пакет Декабрь 30, 2014
- Там же
- Там же
- Там же
- фон Эльтен К.А., Дюран Л.Л., Бэнкс Т.А. и др. Системная воспалительная реакция после пневмококковой вакцины Серия случаев А Hum Вакцина Иммунотер. 2014 июня 1 г.; 10 (6): 1767–1770.
- Хуанг Д.Т., Чиу, Северная Каролина, Чи Х и др. Длительная лихорадка с целлюлитоподобной реакцией у детей, вакцинированных пневмококковым полисахаридом. Педиатр Infect Dis J. 2008 Oct;27(10):937-9.
- Юсеф Э., Маннан С. Системная реакция на пневмококковую вакцину: насколько распространена в педиатрии? Аллергия Астма Учеб. 2008 Jul-Aug;29(4):397-9
- Габор Э.П., Симан М. Острая лихорадочная системная реакция на поливалентную пневмококковую вакцину. JAMA. 1979 Nov 16;242(20):2208-9.
- Хасан С., Юсеф М., Шридхарани С. Тяжелая лихорадочная системная реакция на пневмококковую вакцину. J Natl Med Assoc. 2005 февраль; 97 (2): 284–285.
- Ли А., Гоял Р., Шан ХИ. Тяжелая продолжительная лихорадка после пневмококковой вакцины. Доктор медицинских наук. 2006 Dec;332(6):351-3.
Эта статья обобщена и переведена Национальный центр информации о прививках.

