Obblighi dei vaccini Covid-19: 20 fatti scientifici che sfidano le ipotesi

IPOTESI: i vaccini COVID-19 riducono in modo significativo la diffusione della COVID-19, quindi alti tassi di vaccinazione universale preverranno i focolai e porranno fine alla pandemia |
FATTO #1: uno studio su un focolaio di COVID-19 nel luglio 2021 pubblicato su Eurosurveillance ha rilevato che "tutte le trasmissioni tra pazienti e personale si sono verificate tra individui con mascherina e vaccinati, come si è verificato in un focolaio in Finlandia". Gli autori affermano che lo studio "mette in discussione l'ipotesi che alti tassi di vaccinazione universale portino all'immunità di gregge e prevengano i focolai di COVID-19".1
FATTO #2: uno studio del Centers for Disease Control and Prevention su un altro focolaio di COVID-19 nel luglio 2021 ha rilevato che il 74% dei casi era completamente vaccinato.2
FATTO #3: Uno studio di Harvard che ha analizzato i casi di COVID-19 in 68 Paesi e in 2.947 contee degli Stati Uniti non ha riscontrato "alcun segnale significativo di diminuzione dei casi di COVID-19 in presenza di percentuali più elevate di popolazione completamente vaccinata".3
IPOTESI: i vaccini COVID-19 prevengono il decesso per COVID-19 |
FATTO #4: Gli studi clinici hanno osservato decine di migliaia di soggetti e sono gli unici che hanno incluso un gruppo di controllo e in cui tutti i soggetti sono stati monitorati e testati per la COVID-19 indipendentemente dallo stato di vaccinazione. Tuttavia, questi studi non hanno rilevato un numero di decessi per COVID-19 sufficiente a misurare una differenza significativa nella mortalità tra pazienti vaccinati e non vaccinati.4-7 La Food and Drug Administration (FDA) statunitense afferma che: "Per confermare l'efficacia del vaccino contro la mortalità sarebbe necessario un numero maggiore di individui ad alto rischio di COVID-19 e tassi di attacco più elevati".4-7
FATTO #5: Uno studio su un focolaio di COVID-19 nel luglio 2021 pubblicato su Eurosurveillance ha osservato che il 100% dei casi gravi, critici e fatali di COVID-19 si sono verificati in individui vaccinati.1
FATTO #6: i dati CDC mostrano che la vaccinazione di massa con il vaccino COVID-19 non ha avuto un impatto misurabile sul tasso di mortalità da COVID-19 negli Stati Uniti. Nei nove mesi precedenti l'introduzione della vaccinazione di massa (da aprile 2020 a dicembre 2020), si sono verificati circa 356.000 decessi da COVID-19, ovvero 39.500 decessi al mese - un tasso di mortalità di 0,120 per 1.000 persone. Nei nove mesi successivi all'introduzione della vaccinazione di massa (da gennaio 2021 a settembre 2021), si sono verificati 342.000 decessi da COVID-19 o 38.000 decessi al mese - un tasso di mortalità di 0,115 per 1.000 persone. Nei cinque mesi successivi (da ottobre 2021 a febbraio 2022), si sono verificati altri 249.000 decessi da COVID-19, ovvero 49.800 decessi al mese, con un tasso di mortalità pari a 0,151 per 1.000 persone.7
IPOTESI: per i bambini, l'iniezione del vaccino COVID-19 è più sicura dell'infezione da SARS-CoV-2. |
FATTO #7: nello studio clinico di Pfizer, non si sono verificati casi di COVID-19 grave nei bambini che non hanno ricevuto il vaccino.8-9 Al contrario, per i bambini di 5 anni o più, lo studio clinico di Pfizer sul vaccino COVID-19 ha riscontrato che il vaccino provoca reazioni sistemiche gravi (di grado 3) che includono febbre superiore a 39° C, vomito che richiede idratazione per via endovenosa, diarrea nelle 24 ore e affaticamento grave, cefalea grave, dolori muscolari gravi o dolori articolari gravi che impediscono l'attività quotidiana.9-12
FATTO #8: nello studio clinico, una percentuale compresa tra 1 su 59 e 1 su 143 bambini vaccinati di età compresa tra 5 e 11 anni ha manifestato reazioni sistemiche gravi entro sette giorni dalla seconda dose. Nel gruppo vaccinato sono stati osservati da 3 a 8 casi di reazioni sistemiche gravi per ogni 10 casi di COVID-19 non gravi nel gruppo non vaccinato.9
FATTO #9: nello studio clinico, 1 adolescente vaccinato su 9 di età compresa tra i 12 e i 15 anni ha manifestato reazioni sistemiche gravi entro sette giorni dal ricevimento della seconda dose. Le reazioni sistemiche gravi osservate nel gruppo dei vaccinati sono state 7 volte maggiori rispetto ai casi non gravi di COVID-19 nel gruppo dei non vaccinati.10-12
FATTO #10: Lo studio clinico ha anche rilevato che 1 su circa 1.100 bambini vaccinati di età compresa tra 12 e 15 anni ha avuto una reazione sistemica di grado 4 (febbre superiore a 39° C) dopo la prima dose che ha richiesto una visita al pronto soccorso e il ritiro dallo studio.10-13
IPOTESI: lo studio clinico sul vaccino COVID-19 è stato sufficientemente ampio da dimostrare la sicurezza nei bambini.
|
FATTO #11: Lo studio clinico di Pfizer non aveva una potenza statistica sufficiente per dimostrare che il vaccino è sicuro nei bambini di età inferiore ai 18 anni, in quanto lo studio non includeva un numero sufficiente di soggetti per stabilire la sicurezza (cioè, lo studio clinico includeva solo circa 2.600 bambini vaccinati di età compresa tra i 5 e i 15 anni).9-14 In confronto, è noto che i decessi dovuti al COVID-19 sono rari nei bambini. Al 3 novembre 2021, la probabilità che un ragazzo di 17 anni o meno contragga la SARS-CoV-2 e muoia a causa del COVID-19 era di 1 su 126.000 o 0,0008%.15
Lo studio clinico sul vaccino COVID-19 è inadeguato a dimostrare la sicurezza nei bambini
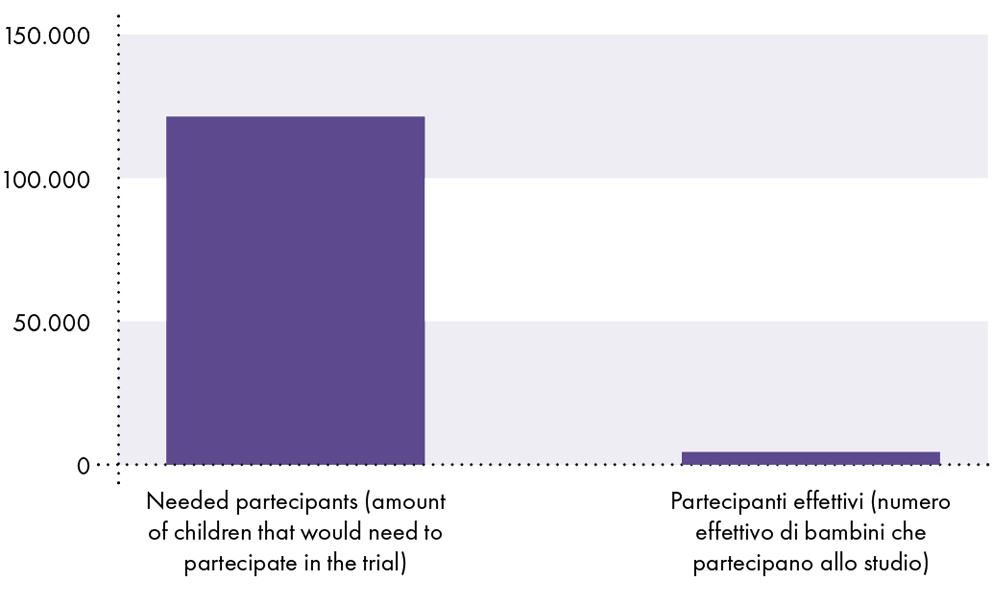
Poiché la probabilità che un bambino contragga la SARS-CoV-2 e muoia a causa del COVID-19 è dello 0,0008% o 1 su 126.000, sono necessari almeno 126.000 bambini per rilevare un decesso a causa del COVID-19. Pertanto, devono esserci almeno 126.000 partecipanti vaccinati arruolati nello studio clinico per confrontare il rischio di morte da COVID-19 con il rischio di morte da vaccino. Tuttavia, solo circa 2.600 bambini vaccinati hanno partecipato allo studio clinico.
IPOTESI: È noto che i vaccini COVID-19 non hanno effetti collaterali a lungo termine.
|
FATTO #12: Poiché tutti i soggetti degli studi clinici sono stati osservati solo per due o sei mesi, non si conosce la sicurezza a lungo termine dei vaccini COVID-19 per nessuna fascia di età. Secondo l'FDA, non ci sono attualmente dati sufficienti per trarre conclusioni sulla sicurezza dei vaccini di Pfizer, Moderna e Johnson & Johnson in sottopopolazioni quali individui in gravidanza e in allattamento e individui immunocompromessi.4-8-16 Per Pfizer, il vaccino "non è stato valutato per il potenziale di causare cancerogenicità, genotossicità o compromissione della fertilità maschile".17
FATTO #13: i rapporti di sorveglianza sulla sicurezza hanno identificato gravi rischi di miocardite e pericardite in soggetti di età inferiore ai 40 anni, entro sette giorni dalla vaccinazione. Nei ragazzi di 16 o 17 anni, l'FDA ha segnalato un eccesso di rischio di miocardite o pericardite di 1 su 5.000 dopo la seconda dose del vaccino Pfizer COVID-19.18 E nei ragazzi di età compresa tra i 12 e i 17 anni, sempre dopo una seconda dose del vaccino Pfizer COVID-19, uno studio di Hong Kong ha riscontrato un eccesso di rischio di miocardite o pericardite di 1 su 2.700.19
IPOTESI: I richiami risolveranno il problema del calo dell'immunità vaccinale.
|
FATTO #14: Gli studi clinici hanno rilevato che l'immunità da vaccino diminuisce significativamente in un breve periodo di tempo. Ad esempio, l'efficacia del vaccino Pfizer è diminuita dall'8% al 18% in soli sei mesi e l'efficacia del vaccino Johnson & Johnson è diminuita dal 25% al 29% in soli sei mesi.20-21 Inoltre, l'efficacia misurata negli studi clinici era contro il ceppo originale di Wuhan, non contro le nuove varianti.
FATTO #15: negli studi clinici, una terza dose di vaccino Pfizer o Moderna o una seconda dose di vaccino Johnson & Johnson non è stata valutata per l'efficacia contro la malattia, ma piuttosto è stata osservata la conta degli anticorpi in un piccolo numero di soggetti vaccinati per un solo mese.18-21-22
IPOTESI: Non sono note opzioni efficaci di trattamento o prevenzione per la COVID-19, ad eccezione dei vaccini.
|
FATTO #16: I trattamenti per la COVID-19 sono migliorati in modo significativo dall'inizio della pandemia all'inizio del 2020, con un conseguente miglioramento dei tassi di sopravvivenza nei casi ospedalizzati.23-24 Infatti, per le persone che non vivono in una casa di cura, il tasso di sopravvivenza complessivo della COVID-19 è del 99,8% negli Stati Uniti e del 99,999% per i bambini in particolare.25-26
FATTO #17: Centinaia di studi hanno osservato l'efficacia di vari trattamenti, i più studiati dei quali sono l'ivermectina, la vitamina D, l'idrossiclorochina (HCQ) e gli anticorpi monoclonali.27-30 Questi trattamenti possono anche essere utili per la profilassi (cioè la prevenzione pre-esposizione o post-esposizione delle infezioni sintomatiche da COVID-19).31-35
IPOTESI: Le persone che sono state precedentemente infettate dal SARS-CoV-2 devono vaccinarsi perché l'immunità naturale è insufficiente. |
FATTO #18: È dimostrato che una precedente infezione da SARS-CoV-2 è più efficace nel prevenire l'infezione da SARS-CoV-2 rispetto ai vaccini COVID-19. Lo studio clinico sul vaccino COVID-19 di Johnson & Johnson ha incluso oltre 2.000 soggetti che avevano contratto la SARS-CoV-2 prima dello studio. Lo studio, che ha testato in modo uniforme persone non vaccinate e vaccinate, ha registrato l'incidenza della COVID-19 nel gruppo non vaccinato almeno 28 giorni dopo la vaccinazione degli altri soggetti dello studio. L'incidenza di COVID-19 del gruppo non vaccinato con precedente infezione da SARS-CoV-2 è stata dello 0,1% (2/2.021), mentre l'incidenza di COVID-19 dei soggetti vaccinati è stata dello 0,59% (113/19.306). Questi dati suggeriscono che i casi di COVID-19 nei soggetti vaccinati sono 6 volte superiori a quelli dei soggetti non vaccinati precedentemente infettati con SARS-CoV-2.36
FATTO #19: i dati dello studio clinico di Johnson & Johnson indicano anche che una persona non vaccinata, precedentemente infettata con il SARS-CoV-2, ha il 99,9% di probabilità di essere protetta da una nuova infezione. Da notare che al 1° luglio 2021, negli Stati Uniti sono stati registrati 177,4 milioni di infezioni da SARS-CoV-2, pari al 53,8% della popolazione statunitense.26-36
IPOTESI: È stato dimostrato che i vaccini obbligatori creano un ambiente più sicuro. |
FATTO #20: L'infezione e la trasmissione del SARS-CoV-2 si verificano ad alti tassi nelle popolazioni completamente vaccinata e una percentuale significativa di casi gravi, critici e fatali di COVID-19 si verifica in individui completamente vaccinati. I dati del CDC mostrano che la vaccinazione di massa con i vaccini COVID-19 non hanno avuto un impatto misurabile sulla mortalità da COVID-19 negli Stati Uniti. Inoltre, i dati degli studi clinici a breve termine indicano che da 1 su 6 a 1 su 9 persone di età compresa tra i 12 e i 55 anni che ricevono il vaccino COVID-19 a base di mRNA soffrono di reazioni sistemiche gravi (di grado 3) e non sono stati condotti studi di sicurezza a lungo termine.13-37 Pertanto, i dati scientifici dimostrano che l'obbligo vaccinale non è in grado di creare un ambiente più sicuro.
Riferimenti
- Shitrit P, Zuckerman NS, Mor O, Gottesman BS, Chowers M. Nosocomial outbreak caused by the SARS-CoV-2 Delta variant in a highly vaccinated population, Israel, July 2021. Euro Surveill. 2021 Sep;26(39). https://pubmed.ncbi.nlm.nih.gov/34596015/.
- Brown CM, Vostok J, Johnson H, Burns M, Gharpure R, Sami S, Sabo RT, Hall N, Foreman A, Schubert PL, Gallagher GR, Fink T, Madoff LC, Gabriel SB, MacInnis B, Park DJ, Siddle KJ, Harik V, Arvidson D, Brock-Fisher T, Dunn M, Kearns A, Laney AS. Outbreak of SARS-CoV-2 infections, including COVID-19 vaccine breakthrough infections, associated with large public gatherings—Barnstable County, Massachusetts, July 2021. MMWR Morb Mortal Wkly Rep. 2021 Aug 6;70(31):1059-62. https://www.cdc.gov/mmwr/volumes/70/wr/mm7031e2.htm?s_cid=mm7031e2_w.
- Subramanian SV, Kumar A. Increases in COVID-19 are unrelated to levels of vaccination across 68 countries and 2947 counties in the United States. Eur J Epidemiol. 2021 Sep 30:1-4. https://pubmed.ncbi.nlm.nih.gov/34591202/.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: Moderna COVID-19 vaccine. Vaccines and Related Biological Products Advisory Committee Meeting: December 17, 2020. https://www.fda.gov/media/144434/download.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. Vaccines and Related Biological Products Advisory Committee Meeting: February 26, 2021. Table 22: vaccine efficacy of first occurrence of moderate to severe/critical and severe/critical COVID-19 including non-centrally confirmed cases with onset at least 14 or at least 28 days after vaccination, by country of participation, per-protocol set, study 3001; 37. https://www.fda.gov/media/146217/download.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: Pfizer-BioNTech COVID-19 vaccine. Vaccines and Related Biological Products Advisory Committee Meeting: December 10, 2020. https://www.fda.gov/media/144245/download.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. COVID data tracker: trends in number of COVID-19 cases and deaths in the US reported to CDC, by state/territory; [cited 2022 Apr 2]. https://covid.cdc.gov/covid-data-tracker/#trends_totaldeaths.
- U.S. Food and Drug Administration, Center for Biologics Evaluation and Research (CBER) Office of Vaccines Research and Review (OVRR). Washington, D.C.: U.S. Department of Health and Human Services. Emergency use authorization (EUA) amendment for an unapproved product: review memorandum; 2021 Apr 9: 23, 39. https://www.fda.gov/media/148542/download.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: EUA amendment request for Pfizer-BioNTech COVID-19 vaccine for use in children 5 through 11 years of age. Vaccines and Related Biological Products Advisory Committee Meeting: October 26, 2021. https://www.fda.gov/media/153447/download.
- Wallace M. Grading of recommendations, assessment, development, and evaluation (GRADE): Pfizer-BioNTech COVID-19 Vaccine. COVID-19 Vaccines Work Group of the Advisory Committee on Immunization Practices (ACIP). Centers for Disease Control and Prevention. 2021 May 12: 24, 25. https://www.cdc.gov/vaccines/acip/meetings/downloads/slides-2021-05-12/03-COVID-Wallace-508.pdf.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. Grading of recommendations, assessment, development, and evaluation (GRADE): Pfizer-BioNTech COVID-19 vaccine for persons aged 12-15 years; [cited 2021 May 14]. https://www.cdc.gov/vaccines/acip/recs/grade/covid-19-pfizer-biontech-vaccine-12-15-years.html#table03d.
- Pfizer. New York (NY): Pfizer Inc. Fact sheet for healthcare providers administering vaccine (vaccination providers); revised 2022 Jan 3. Table 11: vaccine efficacy – first COVID-19 occurrence from 7 days after dose 2: without evidence of infection and with or without evidence of infection prior to 7 days after dose 2 – blinded placebo-controlled follow-up period, adolescents 12 through 15 years of age evaluable efficacy (7 days) population; 48. https://www.fda.gov/media/153713/download.
- Physicians for Informed Consent. Pfizer COVID-19 Vaccine: Short-Term Efficacy & Safety Data. Dec 2021. https://www.physiciansforinformedconsent.org/COVID-19-vaccines.
- Pfizer. New York (NY): Pfizer Inc. Fact sheet for healthcare providers administering vaccine (vaccination providers); revised 2022 Jan 3: 48. https://www.fda.gov/media/153713/download.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. Weekly updates by select demographic and geographic characteristics: provisional death counts for coronavirus disease (COVID-19); [cited 2021 Nov 3]. https://www.cdc.gov/nchs/nvss/vsrr/covid_weekly/index.htm#AgeAndSex.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. Vaccines and Related Biological Products Advisory Committee Meeting: February 26, 2021. https://www.fda.gov/media/146217/download.
- Pfizer. New York (NY): Pfizer Inc. Comirnaty (COVID-19 vaccine, mRNA) suspension for injection, for intramuscular use; revised 2021 Dec. https://www.fda.gov/media/151707/download.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: Application for licensure of a booster dose for Comirnaty (COVID-19 Vaccine, mRNA). Vaccines and Related Biological Products Advisory Committee Meeting: September 17, 2021. https://www.fda.gov/media/152176/download.
- Chua GT, Kwan MYW, Chui CSL, Smith RD, Cheung EC, Tian T, Leung MTY, Tsao SSL, Kan E, Ng WKC, Man Chan VC, Tai SM, Yu TC, Lee KP, Wong JSC, Lin YK, Shek CC, Leung ASY, Chow CK, Li KW, Ma J, Fung WY, Lee D, Ng MY, Wong WHS, Tsang HW, Kwok J, Leung D, Chung KL, Chow CB, Chan GCF, Leung WH, To KKW, Yuen KY, Lau YL, Wong ICK, Ip P. Epidemiology of acute myocarditis/pericarditis in Hong Kong adolescents following Comirnaty vaccination. Clin Infect Dis. 2021 Nov 28:ciab989. https://pubmed.ncbi.nlm.nih.gov/34849657.
- Thomas SJ, Moreira ED Jr, Kitchin N, Absalon J, Gurtman A, Lockhart S, Perez JL, Pérez Marc G, Polack FP, Zerbini C, Bailey R, Swanson KA, Xu X, Roychoudhury S, Koury K, Bouguermouh S, Kalina WV, Cooper D, Frenck RW Jr, Hammitt LL, Türeci Ö, Nell H, Schaefer A, Ünal S, Yang Q, Liberator P, Tresnan DB, Mather S, Dormitzer PR, Şahin U, Gruber WC, Jansen KU; C4591001 Clinical Trial Group. Safety and efficacy of the BNT162b2 mRNA covid-19 vaccine through 6 months. N Engl J Med. 2021 Nov 4;385(19):1761-73. https://pubmed.ncbi.nlm.nih.gov/34525277.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: EUA amendment request for a booster dose for the Janssen COVID-19 vaccine. Vaccines and Related Biological Products Advisory Committee Meeting: October 15, 2021. 21, 39. https://www.fda.gov/media/153037/download.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: EUA amendment request for a booster dose for the Moderna COVID-19 vaccine. Vaccines and Related Biological Products Advisory Committee Meeting: October 14, 2021. https://www.fda.gov/media/152991/download.
- Horwitz LI, Jones SA, Cerfolio RJ, Francois F, Greco J, Rudy B, Petrilli CM. Trends in COVID-19 risk-adjusted mortality rates. J Hosp Med. 2021 Feb;16(2):90-2. https://www.journalofhospitalmedicine.com/jhospmed/article/230561/hospital-medicine/trends-covid-19-risk-adjusted-mortality-rates.
- Dennis JM, McGovern AP, Vollmer SJ, Mateen BA. Improving survival of critical care patients with coronavirus disease 2019 in England: a national cohort study, March to June 2020. Crit Care Med. 2021 Feb 1;49(2):209-14. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7803441/.
- Ioannidis, JPA. Reconciling estimates of global spread and infection fatality rates of COVID- 19: an overview of systematic evaluations. Eur J Clin Invest. 2021;51:e13554. https://onlinelibrary.wiley.com/doi/epdf/10.1111/eci.13554.
- Physicians for Informed Consent. COVID-19 — Disease Information Statement (DIS). Aug 2021. https://physiciansforinformedconsent.org/covid-19/.
- C19early.com. COVID-19 early treatment: real-time analysis of 1,298 studies; [cited 2022 Jan 11]. https://c19early.com/.
- Regeneron. Tarrytown, (NY): Regeneron Pharmaceuticals, Inc. Fact sheet for health care providers: emergency use authorization (EUA) of REGEN-COV (casirivimab and imdevimab); revised 2021 Dec. https://www.regeneron.com/downloads/treatment-covid19-eua-fact-sheet-for-hcp.pdf.
- Lilly. Indianapolis (IN): Eli Lilly and Company. Neutralizing antibodies for COVID-19; [cited 2022 Feb 9]. https://www.lilly.com/news/media/media-kits/bamlanivimab-covid19.
- GSK. London (UK): GlaxoSmithKline plc. GSK and Vir Biotechnology announce United States government agreement to purchase additional supply of sotrovimab, authorised for the early treatment of COVID-19; 2022 Jan 11 [cited 2022 Feb 9]. https://www.gsk.com/en-gb/media/press-releases/gsk-and-vir-biotechnology-announce-united-states-government-agreement-to-purchase-additional-supply-of-sotrovimab.
- C19early.com. COVID-19 studies: ivermectin; [cited 2022 Feb 12]. https://c19ivermectin.com.
- Bryant A, Lawrie TA, Dowswell T, Fordham EJ, Mitchell S, Hill SR, Tham TC. Ivermectin for prevention and treatment of COVID-19 infection: a systematic review, meta-analysis, and trial sequential analysis to inform clinical guidelines. Am J Ther. 2021 Jun 21;28(4):e434-60. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8248252/.
- C19early.com. COVID-19 studies: vitamin D; [cited 2022 Feb 12]. https://c19vitamind.com.
- Ilie PC, Stefanescu S, Smith L. The role of vitamin D in the prevention of coronavirus disease 2019 infection and mortality. Aging Clin Exp Res. 2020 Jul;32(7):1195-8. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7202265/.
- C19early.com. HCQ for COVID-19: real-time meta analysis of 303 studies; [cited 2022 Jan 10]. https://hcqmeta.com.
- U.S. Food and Drug Administration, Vaccines and Related Biological Products Advisory Committee. FDA briefing document: Janssen Ad26.COV2.S vaccine for the prevention of COVID-19. Vaccines and Related Biological Products Advisory Committee Meeting: February 26, 2021. Table 14: vaccine efficacy of first occurrence of moderate to severe/critical COVID-19, including non-centrally confirmed cases, with onset at least 14 or at least 28 days after vaccination, by baseline SARS-CoV-2 status, per protocol set; 30. https://www.fda.gov/media/146217/download.
- El Sahly HM, Baden LR, Essink B, Doblecki-Lewis S, Martin JM, Anderson EJ, Campbell TB, Clark J, Jackson LA, Fichtenbaum CJ, Zervos M, Rankin B, Eder F, Feldman G, Kennelly C, Han-Conrad L, Levin M, Neuzil KM, Corey L, Gilbert P, Janes H, Follmann D, Marovich M, Polakowski L, Mascola JR, Ledgerwood JE, Graham BS, August A, Clouting H, Deng W, Han S, Leav B, Manzo D, Pajon R, Schödel F, Tomassini JE, Zhou H, Miller J; COVE Study Group. Efficacy of the mRNA-1273 SARS-CoV-2 vaccine at completion of blinded phase. N Engl J Med. 2021 Nov 4;385(19):1774-85. Suppl appendix; 36-7. https://www.nejm.org/doi/suppl/10.1056/NEJMoa2113017/suppl_file/nejmoa2113017_appendix.pdf.
Articolo tradotto da Physicians for Informed Consent



