Il vaccino contro l'Epatite B può causare lesioni e/o morte?

Nel 1981 la Food and Drug Administration (FDA) americana autorizzò un vaccino per l’epatite B plasma-derivato che conteneva antigeni prelevati da individui infetti. Tale vaccino fu poi ritirato dal mercato perché, come tutti i vaccini prodotti da sangue umano, era in grado di trasmettere virus non voluti e potenzialmente pericolosi. Nel 1986 fu autorizzato il primo di una serie di vaccini geneticamente modificati (a DNA ricombinante).
Numerosi studi hanno indagato sulla probabilità che chi aveva ricevuto il vaccino plasma-derivato potesse aver ricevuto anche virus non voluti, soprattutto l'HIV precursore dell'AIDS.(1-2) Inoltre, gli studi clinici per attestare la sicurezza dell'attuale vaccino per l'epatite B sono stati effettuati solo su 147 bambini sani monitorati per soli 5 giorni dopo la somministrazione(3) Si tratta di un campione non sufficientemente ampio né di un periodo abbastanza lungo per determinare le reali incidenze degli eventi avversi. Le stesse aziende produttrici hanno ammesso che “l'utilizzo diffuso del vaccino potrebbe far emergere reazioni avverse non osservate negli studi clinici”.(4)
Anche i soggetti adulti sono stati monitorati solo per cinque giorni dopo la vaccinazione e, malgrado ciò, sono stati comunque segnalati effetti sistemici come artralgia, mialgia, parestesia, dolore a schiena e collo, linfoadenopatia, mal di testa, febbre, malessere, brividi vomito, diarrea, dolori addominali, infezioni del tratto respiratorio superiore, mal d'orecchie e ipotensione.(5)
Malgrado le schede tecniche ufficiali, e altri documenti che propagandano(6) il vaccino antiepatite B, tendano a minimizzare o a negare reazioni avverse gravi, numerosi studi pubblicati su riviste mediche e scientifiche nel mondo e le segnalazioni inoltrate al VAERS(7) confermano diverse patologie come conseguenza della vaccinazione. Alcuni di questi studi vengono sintetizzati di seguito.
Artrite
Nel 1990, subito dopo l'introduzione del vaccino antiepatite B, il British Medical Journal documentò una correlazione tra il vaccino e la poliartrite, una dolorosa infiammazione di cinque o più articolazioni.(8) Lo stesso anno il Journal of Rheumatology pubblicò un documento sull'artrite reattiva dopo vaccinazione antiepatite B.(9)
Nel 1994, il British Journal of Rheumatology rese noti dati che documentavano artrite reumatoide dopo il vaccino(10) e il BMJ pubblicò altri tre rapporti che confermavano la correlazione tra vaccino e artrite reattiva.(11-12) Nel 1995, sullo Scandinavian Journal of Rheumatology uscirono due studi che attestavano casi di artrite post-vaccinale(13-14) e sempre quell'anno il Irish Medical Journal documentò il legame con l'artropatia.(15) Nel 1997, il British Journal of Rheumatology diffuse altri due studi che documentavano diversi casi di poliartrite infiammatoria sempre dopo vaccino(16-17) e nel 1998 il Journal of Rheumatology confermò di nuovo l'artrite reumatoide.(18) Sempre in quell'anno la rivista francese Revue de Médecine Interne, pubblicò uno studio sul morbo di Still con esordio in età adulta - un tipo di artrite raro e doloroso - dopo vaccinazione per epatite A e B.(19) Nel 1999, Rheumatology documentò disturbi reumatologici dopo il vaccino(20) e nel 2000 l'American College of Rheumatology pubblicò una ricerca nella rivista peer-reviewed Arthritis & Rheumatology che documentava la sindrome di Sjogren - rara forma di artrite cronica - dopo vaccinazione antiepatite B.(21)
Malattie autoimmuni e neurologiche compresa la sclerosi multipla
Nel 1983, il New England Journal of Medicine pubblicò uno studio che dimostrava l'insorgenza di polineuropatia - malfunzionamento simultaneo di numerosi nervi - dopo vaccinazione antiepatite B.(22) Nel 1988, l'American Journal of Epidemiology diede conto di “eventi avversi neurologici” multipli dopo il vaccino compresi numerosi casi di sindrome di Guillain-Barré, radicolopatia lombare, neuropatia del plesso brachiale, neurite ottica e mielite trasversa.(23) Lo stesso anno, la rivista Archives of Internal Medicine documentò miastenia grave - una malattia neuromuscolare, autoimmune cronica grave - sempre dopo vaccinazione antiepatite B.(24)
Nel 1991 The Lancet pubblicò un rapporto che documentava demielinizzazione del sistema nervoso centrale dopo il vaccino(25) e nel 1992 Nephron rese noti dati che collegavano la vaccinazione al lupus eritematoso sistemico, una malattia autoimmune cronica che colpisce diversi organi.(26) Sempre nel 1992 la rivista Clinical Infectious Diseases pubblicò uno studio che correlava al vaccino la sindrome di Evans - una rara malattia autoimmune e del sangue con un alto tasso di mortalità(27) e la rivista francese Thérapie diffuse uno studio sulla “paralisi facciale periferica” sempre dopo la somministrazione del farmaco.(28) Inoltre Infectious Disease News divulgò un rapporto che attestava numerosi casi di danno neurologico somigliante alla sclerosi multipla(29) e nel 1993 sul Journal of Hepatology comparve un articolo sulla mielite trasversa - infiammazione del midollo spinale - dopo vaccinazione antiepatite B.(30) Quello stesso anno il giornale francese La Nouvelle Presse Médicale pubblicò dati che confermavano la “mielite acuta” post vaccinale(31) e il Clinical Infectious Diseases documentò “sclerosi multipla classica”.(32) Nel 1994, Archives of Pediatrics and Adolescent Medicine rese noti dati che correlavano il lupus al vaccino(33) e la rivista Acta Neurologica Scandinavica pubblicò un rapporto sull'atassia cerebellare acuta - grave perdita di equilibrio e di coordinazione motoria - dopo la vaccinazione in questione.(34)
Nel 1995, sul Journal of Neurology, Neurosurgery and Psychiatry si segnalò demielinizzazione del sistema nervoso centrale(35) e sull 'American Journal of Neuroradiology la mielite. Gli autori di quest'ultimo studio osservarono che gli eventi avversi di questa natura potevano essere sottoriportati poiché i sintomi sono tardivi.(36) Nel 1996, sia Nephron che la rivista francese Annales de Dermatologie et de Vénéréologie pubblicarono studi che attestavano la correlazione tra lupus eritematoso e vaccino antiepatite B.(37-38) Lo stesso anno il Journal of Hepatology diffuse un rapporto sul legame con la leucoencefalite, infiammazione della sostanza bianca del cervello.(39) Nel 1996, il New England Journal of Medicine documentò crioglobulinemia post vaccinale, una rara malattia autoimmune che compromette la circolazione, causa sanguinamento e altri problemi.(40)
Sul Journal of Autoimmunity si attestò autoimmunità vaccino-indotta(41) e nel 1997 l'Indian Journal of Pediatrics pubblicò uno studio che correlava al vaccino la sindrome di Guillain-Barré, malattia autoimmune che causa danni ai nervi, debolezza muscolare e paralisi.(42) Lo stesso anno il Journal of Korean Medical Science documentò mielite acuta(43) ed emerse anche il legame con la “neuropatia del nervo mentale”.(44)
Su JAMA apparvero poi i dati di 46 persone - per la maggior parte donne - che avevano perso i capelli dopo vaccinazione antiepatite B.(45)
Nel 1998, in soggetti vaccinati furono documentati sia lupus eritematoso che trombocitopenia(46) e nel 1999 ancora alopecia sull'American Journal of Gastroenterology.(47) Lo stesso anno Autoimmunity documentò una polineuropatia demielinizzante, mentre Neurology pubblicò dati che correlavano sclerosi multipla ed encefalite al vaccino.(48-49) Sempre nel 1999, La Nouvelle Presse Médicale scrisse di mielite cervicale post vaccino(50) e nel 2000 si parlò di sclerosi multipla su Neurology.(51) Sempre nel 2000 il Journal of the Medical Association of Thailand scrisse sulla sindrome di Guillain-Barré dopo vaccino antiepatite B a DNA ricombinante(52) e nel 2001 il Clinical Infectious Diseases documentò leucoencefalite.(53) Nel 2004, Neurology pubblicò uno studio che mostrava l'associazione tra il vaccino e un rischio statisticamente rilevante di sclerosi multipla;(54) nel 2006 anche il Chinese Medical Journal documentò la sclerosi multipla.(55) Nel 2008, Neurology diffuse due studi che mostravano una correlazione statisticamente significativa tra vaccinazione antiepatite B nei bambini e lo sviluppo di sclerosi multipla pediatrica (demielinizzazione del sistema nervoso centrale) più di tre anni dopo.(56-57)
Compromissione sensoriale
Numerose pubblicazioni mediche e scientifiche hanno documentato disturbi della visione e dell'udito dopo vaccinazione antiepatite B. Per esempio, nel 1987 The Lancet pubblicò un documento sull'uveite - infiammazione del rivestimento interno dell'occhio che spesso porta a cecità - dopo il vaccino.(58) Nel 1993, sempre su The Lancet, apparvero ulteriori dati che documentavano perdita della vista ed eosinofilia - una malattia del sangue su base allergica - sempre dopo vaccinazione.(59) Nel 1994 Optometry and Vision Science documentò neurite ottica post vaccinale(50) e nel 1995 si parlò di epiteliopatia - un raro disturbo degli occhi che causa peggioramento della vista - su Archives of Ophthalmology.(61) Nel 1996, The Lancet pubblicò un rapporto che documentava “occlusione della vena centrale della retina” dopo il vaccino,(62) mentre su American Journal of Ophthalmology venne citata la sindrome delle macchie bianche bilaterale - che causa perdita della vista in entrambi gli occhi.(63) Sempre nel 1996 La Nouvelle Presse Médicale documentò una neuropapillite - infiammazione e deterioramento del nervo ottico - dopo il vaccino(64) e un'altra rivista francese, Annales d'Otolaryngologie et de Chirurgie Cervico-Faciale, citò la perdita di udito.(65) Nel 1997, La Nouvelle Presse Médicale pubblicò poi due diversi studi che documentavano gravi casi di occlusione della vena centrale della retina dopo vaccinazione.(66-67) Lo stesso anno Nephrology Dialysis Transplantation confermò l'insorgenza di neurite ottica dopo il vaccino(68) e International Ophthalmology attestò “complicazioni oftalmiche” in soggetti vaccinati.(69) Sempre nel 1997, gli Annals of the New York Academy of Sciences e la rivista internazionale Auris, Nasus, Larynx rilevarono perdita dell'udito post vaccinale,(70-71) mentre nel 1998 il Journal of French Ophthalmology pubblicò i dati sull'epiteliopatia.(72) Nel 1999, il BMJ confermò la neurite ottica dopo vaccinazione antiepatite B(73) e Acta Ophthalmologica Scandinavica il papilledema - rigonfiamento del disco ottico.(74) Nel 2001, anche una rivista tedesca, Klinische Monatsblätter Für Augenheilkunde, confermò la neurite ottica post vaccinale.(75)
Malattie del sangue
Nel 1990, subito dopo l'introduzione massiccia sul mercato del vaccino antiepatite B, il BMJ documentò vasculite, un’infiammazione dei vasi sanguigni, dopo la somministrazione del farmaco.(76) Nel 1993, la rivista inglese Thorax fornì conferma(77) e The Lancet pubblicò uno studio sull'eosinofilia, malattia del sangue su base allergica, sempre dopo vaccinazione.(78) Nel 1994 e nel 1995 The Lancet documentò anche trombocitopenia - malattia grave che causa eccessivo sanguinamento, ecchimosi e problemi di coagulazione.(79-80) Nel 1998 fu confermata l'insorgenza di trombocitopenia in numerosi pazienti vaccinati di recente(81) anche dallo Scandinavian Journal of Infectious Diseases confermò e Archives of Disease in Children pubblicò dati a conferma di questa malattia come evento avverso del vaccino.(82) Nel 1999, l'European Journal of Pediatrics confermò ancora una volta la trombocitopenia sia dopo vaccino antiepatite B che MPR(83) e lo stesso anno il Journal of Rheumatology pubblicò due importanti studi di cui il primo aveva dimostrato la correlazione tra vaccino e vasculite(84) e il secondo l’eritermalgia, spasmi vascolari in mani e piedi che causano dolori e bruciori.(85) Nel 2000, Clinical and Experimental Rheumatology studiò casi di poliartrite nodosa(86) - un tipo di vasculite rara, sistemica e necrotizzante (che danneggia le cellule) - e il British Journal of Haematology documentò pancitopenia grave - pericolosa riduzione dei globuli rossi.(87) Nel 2001, il Journal of Rheumatology pubblicò altri dati che confermavano la possibilità di vasculite dopo vaccino antiepatite B ricombinante(88) e la rivista italiana Haematologica confermò la trombocitopenia come evento avverso.(89)
Malattie della pelle
Nel 1989, il New England Journal of Medicine documentò l'eritema nodoso - dolorosa infiammazione della pelle con protuberanze molli - dopo vaccinazione antiepatite B.(90) Nel 1993, il Journal of Rheumatology attestò sia casi di eritema nodoso che di artrite di Takayasu - una forma rara di vasculite.(91) Lo stesso anno la rivista svedese Acta Dermato-Venereologica scrisse di lichen ruber planus dopo vaccinazione(92) - un'eruzione pruriginosa sulla pelle caratterizzata da lesioni spesse e dure vicine le une alle altre che ricordano le alghe o i funghi che crescono sulle rocce. Nel 1994, anche Archives of Dermatology documentò lichen planus dopo vaccinazione(93) e Pediatric Dermatology dimostrò un legame con l'eritema multiforme.(94) Nel 1997, l'Australasian Journal of Dermatology confermò la “reazione lichenoide” (lichen planus) dopo il vaccino(95) e il Journal of the American Academy of Dermatology scrisse di anetodermia(96) - raggrinzimento localizzato, perdita di elasticità e atrofia della pelle - dopo vaccinazione. Nel 1998, il British Journal of Dermatology pubblicò due studi che documentavano malattie della pelle post vaccinali: uno era sul lichen planus(97) e l'altro su orticaria e angioedema,(98) patologie con base allergica caratterizzate da bruciore, pizzicore e gonfiore dolorante. Nel 1999, anche sull'International Journal of Dermatology venne menzionato il lichen planus(99) e nel 2000 su Clinical and Experimental Dermatology vennero pubblicati dati a conferma dell'eritema multiforme post vaccinale.(100) Nello stesso anno, il Nepal Journal of Dermatology scrisse nuovamente di lichen planus dopo vaccinazione antiepatite B(101) nel 2001 la menzione comparve sul Journal of the American Academy of Dermatology(102) mentre Pediatric Dermatology parlò di eruzione lichenoide.(103)
Diabete malattie del fegato e dei reni
Nel 1994 The Lancet documentò disfunzioni epatiche dopo vaccinazione antiepatite B(104) e nel 1995 Clinical Nephrology pubblicò uno studio sulla sindrome nefrosica - danno renale - sempre dopo vaccino.(105) Nel 1996 il New Zealand Medical Journal diffuse due documenti che correlavano l'antiepatite B alle epidemie di diabete mellito insulino dipendente (IDDM). Gli autori avevano rilevato che nei tre anni successivi a una campagna di vaccinazione di massa di nuova introduzione e molto estesa, si era registrato un aumento del 60% dei casi di IDDM.(106-107) Nel 1997, Intensive Care Medicine scrisse di infiammazioni epatiche e malattie respiratorie acute dopo vaccinazione (108). Nel 2000, Pediatric Nephrology confermò la possibilità di essere colpiti da sindrome nefrosica dopo avere ricevuto il vaccino.(109) Anche altre pubblicazioni documentarono reazioni avverse a questo vaccino.(110-111-112-113-114-115-116-117-118-119)
La Francia ha eliminato l'antiepatite B dal calendario vaccinale pediatrico
Nel luglio 1998 circa 15.000 cittadini francesi appartenenti a quindici associazioni hanno intentato una causa contro il governo francese sostenendo che aveva ingannato l'opinione pubblica riguardo a rischi e benefici associati al vaccino antiepatite B. Centinaia - forse migliaia - di persone avevano riportato malattie autoimmuni e neurologiche, tra cui la sclerosi multipla, dopo vaccinazione.(120) Di conseguenza, nell'ottobre 1998 la Francia è diventata il primo paese ad abolire l'obbligo di tale vaccino per essere ammessi a scuola.(121)
Il vaccino antiepatite B l'AIDS
Nel 1978 il New York Blood Center di Manhattan, a New York, iniettò a uomini omosessuali un vaccino sperimentale contro l'epatite B, prodotto dalla Merck, per la preparazione del quale erano stati utilizzati scimpanzé. Poco dopo, anche gli omosessuali maschi di San Francisco, Los Angeles, Denver, Chicago e St. Louis ricevettero 3 dosi di quel farmaco nel corso di un periodo di tre mesi.
Nel 1980, nel 20% dei gay maschi che si erano offerti volontari per l'esperimento di Manhattan fu riscontrata positività al virus HIV - la più alta incidenza al mondo, inclusa l'Africa. Nel 1981, l'epidemia di AIDS divenne ufficiale. Malgrado non ci siano prove che il vaccino sperimentale per l'epatite B su quei volontari omosessuali abbia causato l'AIDS, non c'è dubbio che la malattia ebbe un picco subito dopo le somministrazioni.(122)
Quanto è efficace il vaccino antiepatite B?
L’efficacia del vaccino antiepatite B è stata definita iniettando il farmaco a soggetti sui quali sono stati poi misurati gli anticorpi specifici prodotti nel sangue. Tali anticorpi devono corrispondere a determinati livelli, o superarli, stabiliti dagli esperti e che si presume forniscano protezione. Gli scienziati la chiamano «sieroprotezione». Secondo questa definizione, il vaccino è considerato «altamente immunogeno» quando i livelli anticorpali sono misurabili nel breve periodo dopo l'ultima dose di un ciclo di tre richiami.(123) Eppure, secondo le industrie produttrici, la durata dell'effetto protettivo nei vaccinati sani non è nota. Gli studi di follow-up già dai cinque ai nove anni dopo dimostrano che circa la metà di tutti i soggetti vaccinati non ha più livelli protettivi di anticorpi.(124-125)
Per esempio, uno studio pubblicato sul New England Journal of Medicine ha rilevato che dopo cinque anni i livelli anticorpali (che si presume siano collegati all'immunità) erano diminuiti drasticamente o non erano più rilevabili nel 42% dei vaccinati. Inoltre, 34 dei 773 soggetti (il 4,4%) era stato infettato dal virus.(126-127) In un altro studio, meno del 40% dei vaccinati aveva anticorpi protettivi dopo cinque anni.(128)
Una ricerca analoga ha mostrato che il 48% dei soggetti vaccinati aveva livelli anticorpali inadeguati dopo appena quattro anni.(129) Secondo l'Oms, fino al «60% degli adulti perderanno tutti gli anticorpi misurabili indotti dal vaccino antiepatite B nel giro di sei-dieci anni»(130) e la letteratura medica è piena di dati che confermano il fallimento della vaccinazione.(131-132)
Il problema dei vaccini multipli (clicca per aprire)
Il problema dei vaccini multipli

I calendari vaccinali attuali, soprattutto per l’età pediatrica, prevedono la somministrazione di più antigeni e vaccini in un'unica seduta, andando a privilegiare la comodità a discapito della sicurezza. Per poter fare un discorso specifico sulla sicurezza dei vaccini, dobbiamo obbligatoriamente prendere in considerazione la complessità del fenomeno, consigliando tutti i lettori di informarsi adeguatamente su tutti gli aspetti della vaccinazione, pro e contro.
Il Dott. Russell Blaylock,professore assistente clinico di neurochirurgia presso il Centro medico dell'Università del Mississippi, ha studiato per anni la “sinergia tossica” e ha potuto osservare che quando due pesticidi debolmente tossici, dove nessuno dei due è in grado di provocare la sindrome di Parkinson negli animali da esperimento, vengono combinati tra loro, possono causare la malattia anche in modo rapido e paragona questo fenomeno a quello dei vaccini multipli somministrati contemporaneamente: "Le vaccinazioni, se troppo numerose e troppo ravvicinate, si comportano come una malattia cronica".(a). Altri Due studi hanno confermato che si può verificare la morte infantile improvvisa dopo inoculazione di vaccini multipli in un'unica somministrazione.(b-c)
Uno studio pubblicato su Human and Experimental Toxicology ha evidenziato come le nazioni che prescrivono più vaccini in età pediatrica tendano ad avere maggiori tassi di mortalità infantile.(d) Per esempio, negli Stati Uniti, dove i bambini ricevono 26 vaccini, muoiono più di 6 bambini su 1000 nati vivi, al contrario, in Svezia e Giappone, dove si somministrano 12 vaccini in età pediatrica, si riportano 3 morti ogni 1000 nati vivi. Nello studio citato si considera anche il legame tra vaccini e SIDS.
Da uno studio svizzero pubblicato nel 2005 sull'European Journal of Pediatrics(e) si ricava che, in merito agli effetti sui bambini nati pretermine, l'incidenza di apnea ricorrente o aumentata e bradicardia dopo somministrazione di vaccini esavalenti è del 13%. Nello stesso anno, la stessa rivista ha pubblicato uno studio tedesco che aveva esaminato morti infantili improvvise dopo esavalente. Scrivono gli autori: «Questi risultati, basati su segnalazioni spontanee, non provano una relazione causale tra vaccinazione e morte infantile improvvisa, ma costituiscono un segnale riguardo uno dei due esavalenti disponibili; segnale che dovrebbe indurre a intensificare la sorveglianza delle morti infantili improvvise dopo vaccinazione».(f)
Nel 2006, viene pubblicata sulla rivista medica Vaccine(g) la lettera di un team di ricercatori dell'università di Monaco che riportava «sei casi di morte infantile improvvisa dopo vaccinazione esavalente.. Tutti trovati morti senza spiegazione 1-2 giorni dopo la vaccinazione». Erano stati classificati come tipici casi di morte infantile improvvisa ma la verifica autoptica aveva rilevato anomalie neuropatologiche e istologiche e tutti i bambini mostravano un importante edema cerebrale che li rendeva un'eccezione rispetto agli altri casi di SIDS (Sudden Infant Death Syndrome). I ricercatori scrivevano che «Prima dell'introduzione del vaccino esavalente (negli anni 1994-2000), avevamo osservato il caso di un solo bambino su 198 con morte infantile improvvisa, morto subito dopo la vaccinazione DTP. Ma tra il 2001 e il 2004 avevano individuato cinque casi simili su 74 con SIDS. Ciò indicherebbe un aumento di tredici volte».
Sempre nel 2006 su Virchows Archiv(h), il team dell'Istituto di patologia dell'università di Milano ha scritto: «Esperti dell'European Agency for the Evaluation of Medical Products hanno analizzato la possibilità che ci potesse essere un legame tra vaccini esavalenti e alcuni casi di morte. Tra i partecipanti vi erano patologi con esperienza nel campo dei vaccini e della sindrome da morte infantile improvvisa che hanno condotto le autopsie.. ma, per quanto ne sappiamo, è stata prestata scarsa attenzione all'esame del tronco encefalico e del sistema di conduzione del cuore su sezioni seriali e non vi è stata la possibilità di stabilire un ruolo di innesco del vaccino per queste morti. Qui si riporta il caso di una bambina di 3 mesi morta improvvisamente dopo vaccinazione esavalente. L'esame del tronco encefalico su sezioni seriali ha rivelato una ipoplasia bilaterale del nucleo arcuato. Il sistema di conduzione del cuore presentava dispersione fetale persistente e degenerazione. Questo caso offre una comprensione unica del ruolo possibile del vaccino esavalente nell'innescare una conseguenza letale in un bambino vulnerabile. Ogni caso di morte improvvisa e inattesa che accade subito dopo la nascita o nella prima infanzia, soprattutto se dopo una vaccinazione, dovrebbe sempre essere sottoposto a esame necroscopico completo, secondo le linee guida».
Riferimenti
- Blaylock R, "Vaccinations: the hidden dangers", The Blaylock Wellness Report, maggio 2004, pp.1-9
- Ottaviani G. et al., "Sudden infant death syndrome (SIDS) shortly after hexavalent vaccination: another pathology in suspected SIDS?", Virchows Archiv., 2006, 448, pp. 100-104.
- Zinka B. et al., "Unexplained cases of sudden infant death shortly after hexavalent vaccination", Vaccine, luglio 2006, 24 (31-32), pp. 5779-5780.
- Miller N.Z. et a1 . , "Infant mortality rates regressed against number of vaccine doses routinely given: is there a biochemical or synergistic toxicity?", Hum. Exp. Toxicol., maggio 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
Il problema dell'alluminio (clicca per aprire)
Alluminio nei vaccini: cosa devono sapere i genitori

1. Che cos'è l'alluminio?
L'alluminio è un metallo leggero di colore bianco-argenteo, plasmabile e resistente. Queste qualità lo rendono utile in numerosi settori e prodotti, tra cui macchinari, costruzioni, magazzini, pentole, utensili da cucina, tessuti, coloranti e cosmetici. L'alluminio è anche il metallo più abbondante nella crosta terrestre e praticamente tutto l'alluminio presente nell'ambiente si trova nel suolo. Tuttavia, l'alluminio non si trova naturalmente in quantità significative negli organismi viventi (come piante e animali) e non ha alcuna funzione biologica nota. Nell'ultimo secolo, l'uso dell'alluminio in alcuni prodotti ha portato a una maggiore esposizione umana. Le maggiori fonti di esposizione sono gli alimenti contenenti alluminio (ad esempio, lievito in polvere, alimenti trasformati, formule per bambini, ecc.), i prodotti medici (ad esempio, antitraspiranti, antiacidi, ecc.), le iniezioni di allergia e i vaccini.1-3
2. Perché l'alluminio è presente nei vaccini?
Alcuni vaccini utilizzano composti di alluminio (idrossido di alluminio e fosfato di alluminio) come coadiuvanti, ovvero ingredienti che aumentano la risposta immunitaria a un antigene (sostanza estranea).4-5 La Food and Drug Administration (FDA) statunitense afferma che se alcuni vaccini non includessero l'alluminio, la risposta immunitaria che scatenano potrebbe diminuire.6
3. Quali vaccini contengono alluminio?
I seguenti vaccini contengono alluminio e vengono somministrati a neonati, bambini e adolescenti (Fig. 1):
- Epatite B (HepB)
- Esavalente
- Difterite, tetano e pertosse (DTaP e Tdap)
- Haemophilus influenzae tipo b (PedvaxHIB)
- Pneumococco (PCV)
- Epatite A (HepA)
- Papillomavirus umano (HPV)
- Meningococco B (MenB)
Figura 1: Dalla nascita ai 18 anni vengono somministrate fino a 22 dosi di vaccini contenenti alluminio7-8
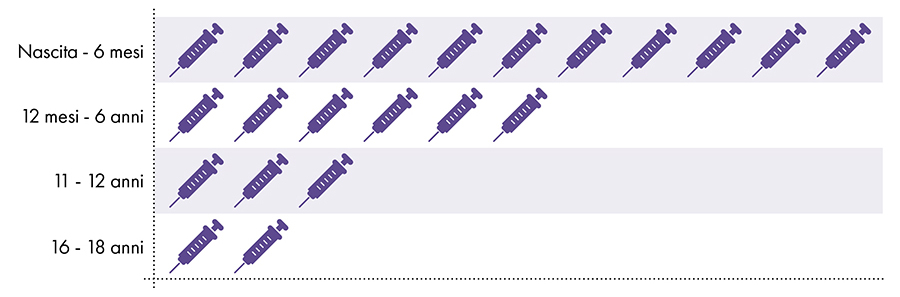
4. L'esposizione all'alluminio è sicura?
La FDA considera l'alluminio generalmente riconosciuto come sicuro (GRAS) dal 1975.9 Tuttavia, prima del 1990, non esisteva la tecnologia per rilevare accuratamente piccole quantità di alluminio somministrate ai soggetti negli studi scientifici.10 Di conseguenza, non si conosceva la quantità di alluminio che poteva essere assorbita prima dell'insorgenza di effetti negativi.
Dal 1990, grazie ai progressi tecnologici, si è osservato che le piccole quantità di alluminio che rimangono nel corpo umano interferiscono con una serie di processi cellulari e metabolici nel sistema nervoso e nei tessuti di altre parti del corpo.1-10-11 I maggiori effetti negativi dell'alluminio sono stati osservati nel sistema nervoso e vanno dalla compromissione delle abilità motorie all'encefalopatia (alterazione dello stato mentale, cambiamenti di personalità, difficoltà di pensiero, perdita di memoria, convulsioni, coma e altro).2-12
Il Dipartimento della Salute e dei Servizi Umani degli Stati Uniti (HHS) riconosce l'alluminio come una neurotossina nota.2 Inoltre, la FDA ha messo in guardia sui rischi della tossicità dell'alluminio nei neonati e nei bambini.13
REGISTRO FEDERALE: Il giornale quotidiano del governo degli Stati Uniti"Anche i neonati a termine con una funzione renale normale possono essere a rischio a causa della rapida crescita e dell'immaturità del cervello e dello scheletro, nonché dell'immaturità della barriera emato-encefalica. Fino all'età di 1 o 2 anni, i neonati hanno un tasso di filtrazione glomerulare inferiore a quello degli adulti, il che influisce sulla loro funzione renale. L'agenzia teme che i bambini piccoli e quelli con funzione renale immatura siano a maggior rischio di esposizione all'alluminio". |
5. Quanto alluminio orale non è sicuro?
Nel 2008 l'Agency for Toxic Substances and Disease Registry (ATSDR), una divisione dell'HHS, ha utilizzato gli studi sugli effetti neurotossici dell'alluminio per stabilire che non si dovrebbe assumere per via orale più di 1 milligrammo (1.000 microgrammi) di alluminio per chilogrammo di peso corporeo al giorno per evitare gli effetti negativi dell'alluminio.2
6. Quanto alluminio iniettato non è sicuro?
Per determinare la quantità di alluminio che può essere iniettata in modo sicuro è necessario convertire il limite di alluminio orale dell'ATSDR. Il limite ATSDR per l'alluminio orale (1.000 microgrammi di alluminio per chilogrammo di peso corporeo al giorno) si basa sullo 0,1% dell'alluminio orale che viene assorbito nel flusso sanguigno, poiché il tratto digestivo blocca quasi tutto l'alluminio orale.2 Al contrario, l'alluminio iniettato per via intramuscolare bypassa il tratto digestivo e il 100% dell'alluminio può essere assorbito nel flusso sanguigno nel corso del tempo (cioè, la proporzione di alluminio assorbito è 1.000 volte maggiore). Per tenere conto di queste diverse quantità di assorbimento, il limite di alluminio orale dell'ATSDR deve essere diviso per 1000. Questa conversione porta a un limite di alluminio nel sangue derivato dall'ATSDR di 1 microgrammo di alluminio (0,1% di 1.000 microgrammi) per chilogrammo di peso corporeo al giorno. Di conseguenza, per evitare gli effetti neurotossici dell'alluminio, non più di 1 microgrammo di alluminio per chilogrammo di peso corporeo dovrebbe entrare nel flusso sanguigno su base giornaliera. La Figura 3 mostra il limite di alluminio nel sangue derivato dall'ATSDR per i neonati di varie età in base al loro peso.
7. Quanto alluminio c'è nei vaccini?
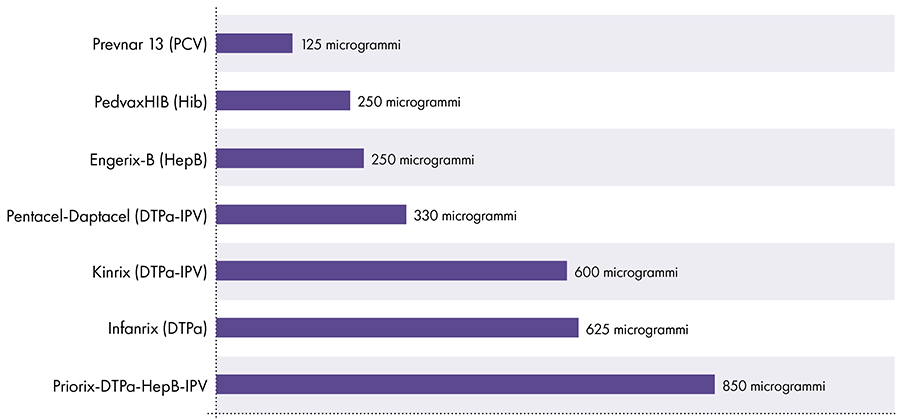
La quantità di alluminio nei vaccini varia.16 Nel 1968, il governo federale americano ha fissato il limite per la quantità di alluminio nei vaccini a 850 microgrammi per dose, in base alla quantità di alluminio necessaria per rendere efficaci alcuni vaccini.6-17 Di conseguenza, la quantità di alluminio nei vaccini infantili contenenti alluminio varia da 125 a 850 microgrammi per dose. La Figura 4 mostra il contenuto di alluminio di una dose di vari vaccini somministrati ai bambini.
8. Alcuni studi hanno confrontato la quantità di alluminio nei vaccini con il limite derivato dall'ATSDR (Agency for Toxic Substances and Disease Registry)?
Nel 2011 è stato pubblicato uno studio che intendeva confrontare la quantità di alluminio nei vaccini con il limite per il flusso sanguigno stabilito dall'ATSDR.18 Tuttavia, questo studio ha erroneamente basato i suoi calcoli sullo 0,78% di alluminio orale assorbito nel flusso sanguigno, anziché sul valore dello 0,1% utilizzato dall'ATSDR nei suoi calcoli.19-20 Di conseguenza, lo studio del 2011 ha ipotizzato che quasi 8 volte (0,78%/0,1%) l'alluminio possa entrare in sicurezza nel flusso sanguigno, e questo ha portato a una conclusione errata.
9. L'esposizione all'alluminio dei vaccini è sicura?
I vaccini vengono iniettati per via intramuscolare e la velocità con cui l'alluminio dei vaccini migra dal muscolo umano al flusso sanguigno non è nota. Gli studi condotti sugli animali suggeriscono che l'alluminio dei vaccini può impiegare da un paio di mesi a più di un anno per entrare nel flusso sanguigno, a causa di molteplici variabili.21-23 Poiché l'esposizione cumulativa all'alluminio dei vaccini nei bambini di età inferiore a un anno supera di diverse centinaia il limite giornaliero stabilito dall'ATSDR (Fig. 3 e 4), il limite sarebbe comunque superato se l'alluminio dei vaccini entrasse nel flusso sanguigno nel corso di circa un anno. Inoltre, alcuni studi hanno dimostrato che l'alluminio dei vaccini viene assorbito dalle cellule immunitarie e raggiunge parti del corpo lontane dal sito di inoculo, compreso il cervello.24
L'entità degli effetti negativi dell'alluminio nei vaccini non è nota, poiché non sono stati condotti studi sulla sicurezza che confrontino una popolazione vaccinata con vaccini contenenti alluminio con una popolazione non vaccinata con tali vaccini.
Limite di alluminio del flusso sanguigno derivato dall’ATSDR2-14-15
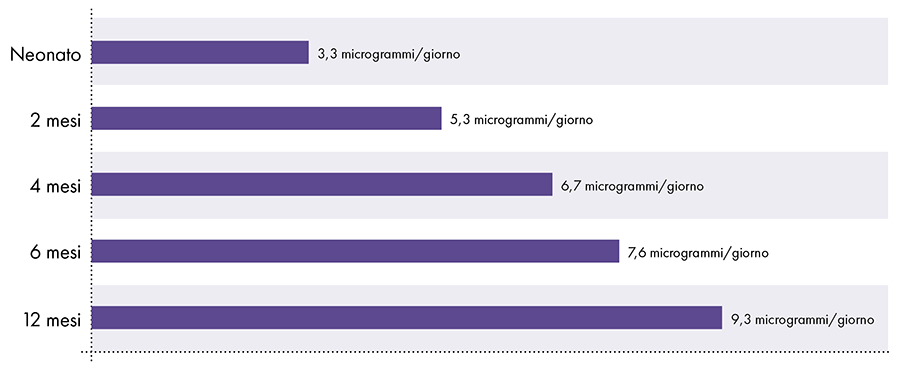 Figura 3: questo grafico mostra il limite di alluminio per i bambini di varie età, come derivato dall'Agenzia per le sostanze tossiche e il registro delle malattie, una divisione del Dipartimento della salute e dei servizi umani degli Stati Uniti. Il limite indica che non più di 1 microgrammo di alluminio per chilogrammo di peso corporeo dovrebbe entrare nel flusso sanguigno su base giornaliera per evitare gli effetti neurotossici dell'alluminio.
Figura 3: questo grafico mostra il limite di alluminio per i bambini di varie età, come derivato dall'Agenzia per le sostanze tossiche e il registro delle malattie, una divisione del Dipartimento della salute e dei servizi umani degli Stati Uniti. Il limite indica che non più di 1 microgrammo di alluminio per chilogrammo di peso corporeo dovrebbe entrare nel flusso sanguigno su base giornaliera per evitare gli effetti neurotossici dell'alluminio.
Quantità di alluminio nei vaccini
Riferimenti
- American Academy of Pediatrics, Committee on Nutrition. Aluminum toxicity in infants and children. Pediatrics. 1996 Mar;97(3):413.
- Agency for Toxic Substances and Disease Registry (ATSDR). Toxicological profile for aluminum. Washington, D.C.: U.S. Department of Health and Human Services; 2008.3, 13-24, 145, 171-7, 208.
- Yokel RA. Aluminum in food—the nature and contribution of food additives. In: El-Samragy Y, editor. Food additive. Rijeka (Croatia): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. Towards an understanding of the adjuvant action of aluminium. Nat Rev Immunol. 2009 Apr;9(4):287.
- Volk VK, Bunney WE. Diphtheria immunization with fluid toxoid and alum-precipitated toxoid. Am J Public Health Nations Health. 1942 Jul;32(7):690-9.
- Baylor NW, Egan W, Richman P. Aluminum salts in vaccines—U.S. perspective. Vaccine. 2002 May 31;20 Suppl 3:S18-22.
- U.S. Food and Drug Administration. Silver Spring (MD): U.S. Food and Drug Administration. Vaccines licensed for use in the United States; [updated 2018 Feb 14; cited 2018 Feb 27]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. Recommended immunization schedule for children and adolescents aged 18 years or younger, United States, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- U.S. Food and Drug Administration. Silver Spring (MD): U.S. Food and Drug Administration. SCOGS (Select Committee on GRAS Substances); [cited 2018 Aug 16]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Priest ND. The biological behaviour and bioavailability of aluminium in man, with special reference to studies employing aluminium-26 as a tracer: review and study update. J Environ Monit. 2004;6:376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. Aluminum in pediatric parenteral nutrition products: measured versus labeled content. J Pediatr Pharmacol Ther. 2011;16(2):92-7.
- Sedman A. Aluminum toxicity in childhood. Pediatr Nephrol. 1992 Jul;6(4):383-93.
- U.S. Food and Drug Administration, Department of Health and Human Services. Rules and regulations. Fed Regist. 2003 Jun;68(100):34286.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. National Center for Health Statistics: Data table for boys length-for-age and weight-for-age charts; [cited 2019 April 2]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Centers for Disease Control and Prevention. Washington, D.C.: U.S. Department of Health and Human Services. National Center for Health Statistics: Data table for girls length-for-age and weight-for-age charts; [cited 2019 April 2]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- U.S Food and Drug Administration, Department of Health and Human Services. Revision of the requirements for constituent materials. Final rule. Fed Regist. 2011 Apr 13;76(71):20513-8.
- Office of the Federal Register, National Archives and Records Service, General Services Administration. Rules and regulations. Fed Regist. 1968 Jan; 33(6):369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Updated aluminum pharmacokinetics following infant exposures through diet and vaccination. Vaccine. 2011 Nov 28;29(51):9538-43.
- Miller S, Physicians for Informed Consent. Erratum in ‘Updated aluminum pharmacokinetics following infant exposures through diet and vaccination.’ In: ResearchGate. Berlin (Germany): ResearchGate GmbH; 2020 Mar 6 [cited 2020 Mar 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Physicians for Informed Consent. Newport Beach (CA): Physicians for Informed Consent. Erratum in ‘Updated aluminum pharmacokinetics following infant exposures through diet and vaccination’; [cited 2020 Mar 6]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. In vivo absorption of aluminium-containing vaccine adjuvants using 26Al. Vaccine 1997 Aug-Sept;15(12-13):1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Aluminium assay and evaluation of the local reaction at several time points after intramuscular administration of aluminium containing vaccines in the Cynomolgus monkey. Vaccine. 2005 Feb 3;23(11):1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanislawski B. Aluminium in plasma and tissues after intramuscular injection of adjuvanted human vaccines in rats. Arch Toxicol. 2019 Oct;93(10):2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. Critical analysis of reference studies on the toxicokinetics of aluminum-based adjuvants. J Inorg Biochem. 2018 Apr;181:87-95.
Articolo tradotto da Physicians for Informed Consent
Riferimenti
- Jacobson I.M et al ., "Lack of effect of hepatitis B vaccine of T-cell phenotypes", NEJM, 1984, 311 (16), pp. 1030-1032.
- Institute of Medicine, Adverse Events Associated with Childhood Vaccines: Evidence Bearing on Causality, National Academy Press, Washington, DC, 1994.
- Merck & Co., Inc. Recombivax HB Hepatitis B Vaccine (Recombinant), Foglietto illustrative al giugno 2005.
- Ibid.
- Ibid.
- Tan L.J., "The hepatitis B vaccine", American Medical Association, AMA helping doctors help patients, www.arna-assn.org, 9 dicembre 2004.
- Vaccine Adverse Event Reporting System VAERS. Rockville, MD.
- Rogers ton S.J. et al . , "Hepatitis B vaccine associated with erythema nodosum and polyarthritis", BMJ, 1990, 301, p. 345.
- Hachulla E. et al., "Reactive arthritis after hepatitis B vaccination Journal of Rheumatology”, 1990, 17, pp. 1250-1251.
- Vautier G. et al ., "Acute sero-positive rheumatoid arthritis occurring after hepatitis vaccination", Br. J. Rheumatol., ottobre 1994, 33 (10), p. 991.
- Hassan W. et al ., "Reiter's syndrome and reactive arthritis in healthcare workers after vaccination", BMJ, 9 luglio 1994, 309 (6967), p. 94.
- Birley H.D. et al ., "Hepatitis B immunization and reactive arthritis", BMJ, dicembre 1994, 309 (6967), p. 1514.
- Gross et al.," Arthritis after hepatitis B vaccination. Report of three cases", Scand. J. Rheumatol., 1995, 24 (1), pp. 50-52.
- Biasi D. et al ., "Rheumatological manifestations following hepatitis B vaccination. Report of three cases", Scand. J. Rheumatol., 1995, 24, pp. 50-52.
- Aherne P. et al., "Psoriatic arthropathy", Irish Medical Journal, marzo-aprile 1995, 88 (2), p. 72.
- Harrison B.J. et al., "Patients who develop inflammatory polyarthritis (IP) after immunization are clinically indistinguishable from other patients with IP", Br. J. Rheum., marzo 1997, 36 (3), pp. 366-369.
- Bracci M. et al ., "Polyarthritis associated with hepatitis B vaccination",Br. J. Rheumatol., febbraio 1997, 36 (2), pp. 300-301.
- Pope J.E. et al ., "The development of rheumatoid arthritis after recombinant hepatitis B vaccination", J. Rheum., settembre 1998, 25 (9), pp. 1687-1693.
- Grasland A et al., "Adult-onset Still's disease after Hepatitis A and B vaccination?",Rev. Med. Interne, febbraio 1998, 19 (2), pp. 134-136.
- Maillefert J.F. et al., "Rheumatic disorders developed after hepatitis B vaccination",Rheumatol. (Oxford), ottobre 1999, 38 (10), pp. 978-983.
- Toussirot E. et al ., "Sjogren's syndrome occurring after hepatitis B vaccination", Arthritis Rheuma, settembre 2000, 43 (9), pp. 2139-2140.
- Ribera E.R. et al ., "Polyneuropathy associated with administration of hepatitis B vaccine", N. Engl. J. Med., 8 settembre 1983, 309 (10), pp. 614-615.
- Shaw F.E. Jr. et al., "Postmarketing surveillance for neurologic adverse events reported after hepatitis B vaccination. Experience of the first three years'', Am. J. Epidemiol., febbraio 1988, 27 (s), pp. 337-352.
- Biron P. et al ., "Myasthenia gravis after general anesthesia and hepatitis B vaccine", Arch. Intern. Med., dicembre 1988, 148 (12), p. 2685.
- Herroelen L. et al . , "Central nervous system demyelination after immunization with recombinant hepatitis B vaccine", The Lancet, 9 novembre 1991, 338 (8776), pp. 1174-1175.
- Tudela P. et al., "Systemic lupus erythematosus and vaccination against hepatitis B", Nephron, 1992, 62 (2), p. 236.
- Martinez E. et al ., "Evan's syndrome triggered by recombinant hepatitis B vaccine'', Clin. Infect. Dis., 1992, 15, p. 1051.
- Ganry 0. et al., "Peripheral facial paralysis following vaccination against hepatitis B. Apropos of a case", Therapie, 1992, 47, pp. 437-438.
- Waisbren B.A., "Other side of the coin (letter)", Inf Dis. News, 1992, 5, p. 2.
- Trevisani F. et al ., "Transverse myelitis following hepatitis B vaccination",]. of Hepatology, settembre 1993, 19 (2), pp. 317-318.
- Mahassin F. et al . , "Acute myelitis after vaccination against hepatitis B",Presse Med., dicembre 1993, 22 (40), pp. 1997-1998.
- Nadler J.P., "Multiple sclerosis and hepatitis B vaccination", Clin. Infect. Dis., novembre 1993, 17 (5), pp. 928-929.
- Mamoux V. et al., "Lupus erthymatosus disseminatus and vaccination against hepatitis B virus", Arch. Pediatr., 1994, 1, pp. 307-309.
- Deisenhammer F. et al., "Acute cerebellar ataxia after immunisation with recombinant hepatitis B vaccine", Acta Neurol. Scand., giugno 1994, 89 (6), pp. 462-463.
- Kaplanski G. et al ., "Central nervous system demyelination after vaccination against hepatitis B and HLA haplotype", J. Neurol. Neurosurg. Psychiatry, giugno 1995, 58 (6), pp. 758-759.
- Tartaglino L.M. et al ., "MR imaging in a case of post vaccination myelitis", Am. J. Neuroradiol., 1995, 16 (3), pp. 581-582.
- Guiserix J., "systemic lupus erythematosus following hepatitis B vaccine",Nephron, 1996, 74 (2), p. 441.
- Grezard P. et al., "Cutaneous lupus erythematosus and buccal aphthosis after hepatitis B vaccination in a 6-year old child", Ann. Dermatol. Venereal., 1996, 123 (10), pp. 657-659.
- Manna R. et al., "Leukoencephalitis after recombinant hepatitis B vaccine", J. of Hepatology, giugno 1996, 24 (6), pp. 764-765.
- Mathieu E. et al ., "cryoglobulinemia after hepatitis B vaccination", New England]. Med., agosto 1996, 335 (5), p.335.
- Cohen AD. et al., "Vaccine-induced autoimmunity", J. Autoimmunity, dicembre 1996, 9 (6), pp. 699-703.
- Kakar A. et al., "Guillain Barre syndrome associated with hepatitis B vaccination", Ind. J. Ped., settembre-ottobre 1997, 64 (5), 710-712.
- Song H.K. et al ., "Acute Myelitis after hepatitis B vaccination", J. Korean Med. Sci., giugno 1997, 12 (3), pp. 249-251.
- Maillefert J.F. et al ., "Mental nerve neuropathy as a result of hepatitis B vaccination", Oral Surgery, Oral Medicine, Oral Pathology, Oral Radiology and Endodontology, giugno 1997, 83 (6), pp. 663-664.
- Wise R.P. et al., "Hair loss after routine immunizations", JAMA, 8 ottobre 1997, 278 (14), pp. 1176-1178.
- Finielz P. et al , "Systemic lupus erythematosus and thrombocytopenic purpura in two members of the same family following hepatitis B vaccine", Nephrol. Dial. Transplant., 1998, 13 (9), pp. 2420-2421.
- Flemrner M. et al ., "The bald truth", Am. J. Gastroenterol., aprile 1999, 94 (4), p. 1104.
- Creange A et al., "Lumbosacral acute demyelinating polyneuropathy following hepatitis B vaccination", Autoimmunity, 1999, 30, pp. 143-146.
- Tourbah A. et al ., "Encephalitis after hepatitis B vaccination: recurrent disseminated encephalitis or MS?", Neurology, 22 luglio 1999, 53 (2), pp. 396-401.
- Renard J.L. et al., "Acute transverse cervical myelitis following hepatitis B vaccination. Evolution of anti-HBs antibodies",Presse Med., 3-10 luglio 1999, 28 (24), pp. 1290-1292.
- Gran B. et al., "Martin R. Development of multiple sclerosis after hepatitis B vaccination", Neurol., 2000, 54 (suppl 3), A164.
- Sinsawaiwong S. et al ., "Guillain-Barre syndrome following recombinant hepatitis B vaccine and literature review", J. Med. Assoc. Thai., settembre 2000, 83 (9), pp. 1124-1126.
- Konstantinou D. et al ., ''Two episodes of leukoencephalitis associated with recombinant hepatitis B vaccination in a single patient", Clin. Inf. Dis., 15 novembre 2001, 33, pp. 1772-1773.
- Heman M.A. et al., "Recombinant hepatitis B vaccine and the risk of multiple sclerosis: a prospective study", Neurology, 2004, 63, pp. 838-842.
- Terney D. et al ., "Multiple sclerosis after hepatitis B vaccination in a 16-year-old patient", Chinese Medical Journal, 2006, 119 (1), pp. 77-79.
- Yann M. et al., "Hepatitis B vaccine and the risk of CNS inflammatory demyelination in childhood", Neurology, 8 ottobre 2008 [pubblicato online].
- Ness J.M. et al “Hepatitis vaccines and pediatric multiple sclerosis. Does timing or type matter?", Neurology, 17 dicembre 2008 (pubblicato online].
- Fried Met al., "Uveitis after hepatitis B vaccination", The Lancet, 12 settembre 1987, pp. 631-632.
- Brezin A. et al., "Visual loss and eosinophilia after recombinant hepatitis B vaccine", The Lancet, 28 agosto 1993, 342 (8870), pp. 563-564.
- Achiron L.R et al., "Postinfectious hepatitis B optic neuritis", Optom. Vis. Sci., 1994, 71, pp. 53-56.
- Brezin A.P. et al., "Acute posterior multifocal placoid pigment epitheliopathy after hepatitis B vaccine", Arch. Ophthalmol., marzo 1995, 113 (3), pp. 297-300.
- Devin F. et al., "Occlusion of central retinal vein after hepatitis B vaccination", The Lancet, giugno 1996, 347 (9015), p. 1626.
- Baglivo E. et al ., "Multiple evanescent white dot syndrome after hepatitis B vaccine", Am. J. Ophthalmol., settembre 1996, 122 (3), pp. 431-432.
- Berkman N. et al ., "Bilateral neuro-papillitis after hepatitis B vaccination", Presse Med., 28 settembre 1996, 25 (28), p. 1301 (francese].
- Bonfils P. et al ., "Fluctuant perception hearing loss after hepatitis B vaccine", Ann. Otolaryngol. Chir. Cervicofac., 1996, 113 (6), pp. 359-361 (francese].
- Granel B. et al ., "Occlusion of the central retinal vein after vaccination against viral hepatitis B with recombinant vaccines. 4 cases", Presse Med., 1 febbraio 1997, 26 (2), pp. 62-65 [francese].
- Berkman N., "A case of segmentary unilateral occlusion of the central retinal vein following hepatitis B vaccination", Presse Med., 26 aprile 1997, 26 (14), p. 670 [francese].
- Albitar S. et al., "Bilateral retrobulbar optic neuritis with hepatitis B vaccination", Nephrol. Dial. Transplant, ottobre 1997, 12 (10), pp. 2169-2170.
- Arya S.C., "Ophthalmic complications of vaccines against hepatitis B virus", Int. Ophth., 1997, 21 (3), pp. 177-178.
- Orlando M.P. et al., "Sudden hearing loss consequent to hepatitis B vaccination: a case report'', Annals of the New York Academy of Sciences, 29 dicembre 1997, 830, pp.319-321.
- Biacabe B. et al ., ”A case report of fluctuant sensorineural hearing loss after hepatitis B vaccination", Auris, Nasus, Larynx, ottobre 1997, 24 ,(4), pp. 357-360.
- Bourges J.L. et al., “Multifocal placoid epitheliopathy and anti-hepatitis B vaccination", J. Fr. Ophtalmol., novembre 1998, 21(9), pp. 696-700 [francese].
- Stewart O. et al ., “Simultaneous administration of hepatitis B and polio vaccines associated with bilateral optic neuritis",Br. J. Ophthalmol., ottobre 1999, 83 (10), pp.1200-1201.
- Fledelius H.C., “Unilateral papilledema after hepatitis B vaccination in a migraine patient. A case report including forensic aspects",Acta Ophthalmol. Scand., dicembre 1999, 77 (6), pp. 722-724.
- Voigt u. et al ., “Neuritis of the optic nerve after vaccinations against hepatitis A hepatitis B and yellow fever", Klin. Monatsbl. Augenheilkd., ottobre 2001, 218 (10), pp. 688-690 (tedesco).
- Cockwell P. et al ., "Vasculitis related to hepatitis B vaccine",BMJ, 1 dicembre 1990, 301 (6763) p.1281.
- Allen M.B. et al., "Pulmonary and cutaneous vasculitis following hep B vaccination", Thorax, maggio 1993, 48 (5), pp. 580-581.
- Nagafuchi S. et al ., "Eosinophilia after intradermal hepatitis B vaccination", The Lancet, 1993, 342, p. 998.
- Poullin P. et al ., "Thrombocytopenic purpura after recombinant hepatitis B vaccine", The Lancet, novembre 1994, 344 (8932), p. 1293.
- Meyboom R.H. et al., "Thrombocytopenia reported in association with hepatitis B and A vaccines", The Lancet giugno 1995, 345 (8965), p. 1638.
- Neau D. et al., "Immune thrombocytopenic purpura after recombinant hepatitis B vaccine: retrospective study of seven cases",Scan J. Infect Dis., 1998, 30 (2), pp. 115- 118.
- Ronchi F. et al ., "Thrombocytopenic purpura as adverse reaction to recombinant hepatitis B vaccine", Arch. Dis. Child., marzo 1998, 78 (3), pp. 273-274.
- Muller A. et al ., "Thrombocytopenic purpura: adverse reaction to acombinedirnmunisation (recombinant hepatitis B and measles-mumps-rubella-vaccine) and after therapy with Co-trimoxazole", Eur. ]. Pediatr., dicembre 1999, 158 Suppi. 3, S209-10.
- Le Hello C. et al., “Suspected hepatitis B vaccination related vasculitis", J. of Rheumatology, gennaio 1999, 26 (1), pp. 191-194.
- Rabaud C. et al., "First case of erythermalgia related to hepatitis B vaccination", J. of Rheum., gennaio 1999, 26 (1), pp. 233-234.
- De Keyser F. et al ., “Immune-mediated pathology following hepatitis B vaccination” Two cases of polyarteritis nodosa and one case of pityriasis rosea-like drug eruption”, Clin. Exp. Rheumatol., gennaio-febbraio 2000, 18 (1), pp. 81-85.
- Viallard J.F. et al ., "Severe pancytopenia triggered by recombinant hepatitis B vaccine", Br. J. Haematol., luglio 2000, 110 (1), pp. 230-233.
- Zaas A. et al ., uLarge artery vasculitis following recombinant hepatitis B vaccination. 2 cases", J. Rheumatol., maggio 2001, 28 (S), pp.1116-11120.
- Conesa V. et al., "Thrombocytopenic Purpura after Recombinant Hepatitis B Vaccine. A rare association", Haematologica, marzo 2001, 86 (3), E09 [italiano].
- Goolsby P.L, "Erythema nodosum after Recombivax HB hepatitis B vaccine", N. Engl. J. Med., ottobre 1989, 321, 1198-1199.
- Castresana-Isla C.J. et al ., "Erythema nodosum and Talkayasu's arteritis after immunization with plasma derived hepatitis B vaccine", J. Rheumatol., agosto 1993, 20(8), pp. 1417-1418.
- 109. Trevisian G. et al ., "Lichen ruber planus following HBV vaccination". Acta Dermato-Venereotogica, febbraio 1993, 73 (1), p. 73.
- Aubin F. et al ., "Lichen planus following hepatitis B vaccination", Archives of Dermatology, ottobre 1994; 130 (10), pp. 1329-1330.
- Di Lernia V. et al., "Bisighini G. Erythema multiforme following hepatitis B vaccine", Ped. Derma., dicembre 1994, 11 (4), pp. 363-364.
- Saywell CA. et al., "Kossard S. Lichenoid reaction to hepatitis B vaccination", Australasian J. Derm., agosto 1997, 38 (3), pp. 152-154.
- Dauod M.S. et al ., "Anetoderma after hepatitis B immunization in two siblings",/. Amer. Acad. Dermatol., maggio 1997, 36 (5 Pt 1), pp. 779-780.
- Ferrando M.F. et al ., "Lichen planus following hepatitis B vaccination” , Br. J. Dermatol., agosto 1998, 139 (2) p. 350.
- Barbaud A. et al ., "Allergic mechanisms and urticaria/angioedema after hepatitis B immunization", Bt. J. Dermatot, novembre 1998, 139 (5), pp. 925-926.
- Schupp P. et al., "Lichen planus following hepatitis B vaccination", Inter. J. of Dermat., ottobre 1999, 38 (10), pp. 799-800.
- Loche F. et al ., " Erythema multiforme associated with hepatitis B immunization", Cfin. Exp. Dermatol., marzo 2000, 25 (2), pp. 167-168.
- Agrawal S. et al ., "Lichen planus after HBV vaccination in a child: a case report from Nepal", J. Dermatol., settembre 2000, 27 (9), pp. 618-620.
- Al-Khenaizan S., "Lichen planus occurring after hepatitis B vaccination: a new case", J. Am. Acad. Dermatol., ottobre 2001, 4S (4), pp. 614-615.
- Usman A. et al ., “Lichenoid eruption following hepatitis B vaccination: first North American case report". Pediatr. Dermato J., mar-apr. 2001, 18 (2) pp. 123-126.
- Lilic D. et al., “Liver dysfunction and DNA antibodies after hepatitis B vaccination", The Lancet, novembre 1994, 344 (8932), pp. 1292-1293.
- Macario F. et al ., “Nephrotic syndrome after recombinant hepatitis B vaccine", Clin. Nephrol., maggio 1995, 43 (5), p. 349.
- Classen John Barthelow, "Childhood immunisation and diabetes mellitus", New Zealand Med. J., 24 maggio 1996, p. 195.
- Classen John Barthe low, ''The diabetes epidemic and the hepatitis B vaccine", New Z. Med. J., 24 maggio 1996, p. 366.
- Ranieri V.M. et al., "Liver inflammation and acute respiratory distress syndrome in a patient receiving hepatitis B vaccine: a possible relationship?", Intensive Care Medicine, gennaio 1997, 23 (1), pp. 119-121.
- Islek I. et al ., “Nephrotic syndrome following hepatitis B vaccination", Pediatr. Nephrol., gennaio 2000, 14, pp. 89-90.
- Snider G.B. et al., "A possible systemic reaction to hepatitis B vaccine", JAMA. 1 marzo 1985, 253 (9), pp. 1260-1261.
- AADRAC, "Australian Adverse Drug Reactions Advisory Committee: Reactions to hepatitis B vaccines”, Australian Adverse Drug Reactions Bulletin, agosto 1990.
- Germanaud J. et al., "A case of severe cytolysis after hepatitis B vaccination", Amer. J. Med., giugno 1995, 98 (6), pp. 595-S96.
- Fisher B.L., Ed., "Hepatitis B vaccine: the untold story", The Vaccine Reaction, National Vaccine Information Center, settembre 1998.
- Belkin Michael, "Government-mandated thalidomide for babies", WorldNetDaily, 25 gennaio 1999, worldnetdaily.com
- Howd A., "Ounce of Prevention, Pound of Misery", Insight Magazine, 12 marzo 1999,
- Bethell T., “Shots in the Dark". American Spectator. maggio 1999.
- Wallstin B., “Immune to Reason", The Houston Press, 3 giugno 1999, www.houstonpress.com
- Shaw F.E., “Uproar over a little known preservative, thimerosal, jostles U.S. hepatitis B vaccine policy”, Hepatitis Control Report, estate 1999, Vol. 4, n. 2.
- Spalding B.J., “Miracle or murder? The hepatitis B vaccine controversy", Biospace.com, 11 novembre 1999, www.biospace.com
- Science, 31 luglio 1998.
- "France suspends use of hepatitis B vaccine”. https://www.bmj.com/content/317/7165/1034.2
- Cantwell A., "The gay experiment that started AIDS in America”, Not Aids, 13 gennaio 2006, ora in http://rense.com/general68/gayex.htm
- Merck & Co.t Inc., Recombivax HB Hepatitis B Vaccine (Recombinant), Foglietto illustrativo al giugno 2005; GlaxoSmithKline Biologicals, Engerix-B (Hepatitis B Vaccine (Recombinant), Foglietto illustrativo al dicembre 2005.
- Wainwright R.B. et al., "Duration of immunogenicity and efficacy of hepatitis B vaccine in a Yupik Eskimo population, preliminary results of an 8-year study", in “Viral hepatitis and liver disease", Hollinger F.B. et al. (eds.), Williams & Wilkins, 1990, pp. 762-766.
- Hadler S.C. et al., "Evaluation of long-term protection by hepatitis B vaccine for 7 to 9 years in homosexual men". in Viral hepatitis and liver disease, Hollinger F.B. et al . (eds .. ), Williams & Wilkinst 1990, pp. 766-768.
- Hadler S.C. et al., “Long-term immunogenicity and efficacy of hepatitis B vaccine in homosexual men", NEJM, 24 luglio 1986, 315, pp. 209-214.
- Stevens C.E. et al., "Prospects for control of hepatitis B virus infection: implications of childhood vaccination and long-term protection", Pediatrics, 1992, 90, pp. 170-173.
- Street A.C. et al., "Persistence of antibody in healthcare workers vaccinated against hepatitis B", Infec. Control Hosp. Epidem., 1990, 11, pp. 525-530.
- Pasko M.T. et al., "Persistence of anti-HBs among health care personnel immunized with hepatitis B vaccine", American Journal of Public Health, 1990, 80, pp. 590-593.
- World Health Organization, ccHepatitis B vaccines: immunogenicity reappraised'', WHO Drug Infor., 1994, 8 (2).
- Ballinger, A.B. et al., "Severe acute hepatitis B infection after vaccination”, The Lancet, 1994, 344, pp.1292-1293
- Goffin E. et al., "Acute hepatitis B infection after vaccination", The Lancet, 1995, 345, p. 263.
Vaccini: guida per una scelta informata di Neil Z. Miller (Autore) e Claudia Benatti (Traduttore)
Terra Nuova Edizioni, 2018
NOTA IMPORTANTE: Corvelva invita a informarsi in modo approfondito leggendo tutte le sezioni e link, oltre che i foglietti illustrativi e schede tecniche dei prodotti del produttore, e a parlare con uno o più professionisti di fiducia prima di decidere di vaccinare se stessi o il proprio bambino. Queste informazioni sono solo a scopo informativo e non sono da intendersi come consigli medici.











