Première publication d'examen par les pairs sur les vaccins MPRV (Priorix Tetra)

Nous y sommes enfin, après presque deux ans la première publication en revue par les pairs de nos analyses sort et bien d'autres suivront.
Ici, nous essayons de résumer dans ces premières pages, de manière très discursive et non technique: ce qui a été publié, sa validité et pourquoi il est important pour notre enquête sur les vaccins.
(Par contre, les pages 3 à XNUMX sont dédiées à une étude technique, laissant l'évaluation de l'article lui-même à ceux qui travaillent dans le secteur)
Ce qui a été publié sur "F1000 Research" 1 il est le résultat de la première partie des travaux réalisés pour le compte de l'Association Corvelva par l'un des laboratoires en charge des analyses. Rappel - parce que plus de deux ans se sont écoulés depuis le début de ces travaux et que de nombreux autres résultats ont été ajoutés aux premiers - que le le premier problème majeur que nous avons dû étudier était la quantité anormale d'ADN humain trouvée dans les vaccins analysés.
Dans les deux vaccins quadrivalents MPRV analysés, des quantités de 1 à 2,7 microgrammes / flacon ont été initialement trouvées (conformément à la publication en question), ce qui nous a amenés à rendre public et immédiatement ce résultat car, simplement, il n'était pas prévu qu'un cette quantité d'ADN était présente dans un vaccin.
Outre les considérations et les conclusions auxquelles les travaux parviennent, qui sont strictement techniques et donc compréhensibles uniquement pour ceux qui font des recherches dans le domaine de la métagénomique, ce qui est observé dans les graphiques est que les deux échantillons de vaccin contenaient un pourcentage élevé de des lectures d'ADN humain en plus de celles attendues du génome du virus de la varicelle (alphaherpès virus humain 3), seulement détectable des quatre, comme une analyse ADN-seq a été présentée dans l'article.
Cependant, nous tenons à souligner que plus tard les quantités d'ADN trouvées et confirmées avec le même méthode qui est maintenant validée ici étaient encore plus élevés: jusqu'à 3,7 microgrammes par flacon, conduisant à une différence significative entre les lots et les lots.
En fait, dans notre rapport divulgué le 22.12.2018 2 les résultats ont été rapportés pour d'autres lots analysés après ceux discutés dans l'article, puis confirmée par des analyses interlaboratoires encore en cours de publication.
Par conséquent, ce qui nous intéresse le plus dans cette publication, c'est qu'elle valide la méthode utilisée, met un point important sur les discussions sur le "type" d'analyses réalisées, et par conséquent confirme de manière décisive tout le travail effectué par la suite avec la méthode NGS: la perspicacité sur le type de matériel génétique contenu, la présence de virus adventices, la grande absence de virus atténués qui devraient plutôt être présents et la quantité plutôt incontrôlable (également parce qu'elle est très différente d'un échantillon à l'autre) de l'ADN humain présent, la population mutante , phages, ADN d'autres espèces, et progressivement tous les résultats que vous trouverez résumés sur notre site. 3
Tout ce que, du point de vue du contenu biologique, nous avons dénoncé ces dernières années, en rapportant servilement les résultats aux organes de contrôle, prend une connotation scientifique plus pertinente (même si, nous le répétons encore, ce ne sont pas les peer-reviews qui devaient inquiéter mais les données présentées, très sérieuses dans leur contenu et dans leurs implications possibles pour la santé humaine). Cependant, maintenant que la publication de la méthode est terminée, nous exigerons d'obtenir les réponses qui ne sont pas encore arrivées.
Ces résultats confirment de manière concluante la présence d'ADN fœtal dans les vaccins tétra Priorix, en quantités variant entre les différents lots, indiquant un contrôle de qualité médiocre de ces produits pharmaceutiques.
Nous rappelons également le rapport sur le séquençage de l'ensemble du génome MRC-5 publié sur le site Internet de Corvelva le 27.09.2019 4 dans laquelle la modification profonde de cet ADN est également évidente dans les gènes associés au développement de pathologies tumorales (autres données en cours de publication).
L'ADN fœtal contaminant présent dans tous les échantillons analysés en quantités variables (donc non contrôlées) est jusqu'à 300 fois supérieur à la limite fixée par l'EMA pour l'ADN cancérigène (10 ng / dose, correspondant à l'ADN contenu dans environ 1000 cellules cancéreuses, obtenu sur la base d'un calcul statistique, alors que la limite de précaution est de 100 pg / dose) limite qui doit nécessairement être appliquée également à l'ADN fœtal qui contamine inévitablement le Priorix Tetra.
Il s'ensuit que ce vaccin doit être considéré comme défectueux et potentiellement dangereux pour la santé humaine, en particulier dans la population pédiatrique beaucoup plus vulnérable aux dommages génétiques et auto-immunes dus à l'immaturité dans les systèmes d'hébergement.
Comme prévu, ce qui suit est plus "technique" et difficile à comprendre pour les non-professionnels, c'est pourquoi nous avons décidé, également par souci de transparence, de joindre à ce document "Dossier EMA - NGS Discussion des résultats de l'enquête sur la qualité des vaccins". Nous n'avons eu qu'à extrapoler la partie divulguée, plus de 50 pages de dossiers par rapport aux 200 de la NGS, car une grande partie des informations contenues et enregistrées auprès des instances réglementaires doivent rester confidentielles. La dure loi de la science exige que les données ne soient publiées dans un magazine que si elles ne sont pas publiées et nous, ayant plusieurs autres publications en cours, ne voulons pas les mettre en danger.
Enfin, pour éviter tout malentendu, nous souhaitons mentionner, dès la publication, la partie de la "Déclaration de financement":
«Le séquençage métagénomique B1 et B2 a été financé par Corvelva (association à but non lucratif, Vénétie, Italie), dans le cadre d'un contrat de service avec le laboratoire. Aucune autre contribution n'a été engagée pour soutenir le travail. Les bailleurs de fonds n'ont joué aucun rôle dans la conception de l'étude, dans la collecte et l'analyse des données, dans la décision de publier ou dans la préparation du manuscrit. "
Pièces jointes:
- Publication - Me convoitez-vous? Effet de la réduction de la couverture sur les études de séquençage du fusil à pompe métagénome
- CORVELVA-fil-NGS-EMA-ita
- PDF - Première publication d'examen par les pairs sur les vaccins MPRV (Priorix Tetra)
Dans l'article «Me convoitez-vous? Effet de la réduction de la couverture sur les études de séquençage du fusil à pompe métagénome "
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
Les auteurs abordent la question technico-méthodologique de savoir s'il est possible d'utiliser une approche de métagénomique parallèle massive avec une faible couverture de lecture pour caractériser des matrices biologiques complexes. Des estimations de la diversité, de l'abondance des espèces sont calculées et la capacité de reconstruire le métagénome de novo en termes de longueur et d'exhaustivité est évaluée, afin de comprendre dans quelle mesure la diminution de la profondeur de séquençage, variée en sous-échantillonnant au hasard les lectures de séquençage, peut Les résultats montrent que les indices de diversité des communautés complexes procaryotes, eucaryotes et virales peuvent être estimés avec précision avec 500.000 1.000.000 lectures ou moins, bien que des échantillons particulièrement complexes puissent nécessiter 1.000.000 XNUMX XNUMX de lectures. A l'inverse, un projet de reconstruction du métagénome et des gènes qu'il contient nécessite un nombre supérieur à XNUMX XNUMX XNUMX de lectures.
Parmi les matrices complexes diverses et très différentes soumises à une analyse métagénomique massive, deux médicaments biologiques ont été inclus, à savoir deux lots différents de vaccin vivant atténué MPRV utilisé pour la vaccination contre la rougeole, les oreillons, la rubéole et la varicelle chez les enfants. L'ADN a été extrait des vaccins, des bibliothèques génomiques ont ensuite été construites en utilisant des protocoles commerciaux standard et un séquençage massif avec la technologie Illumina a été effectué.
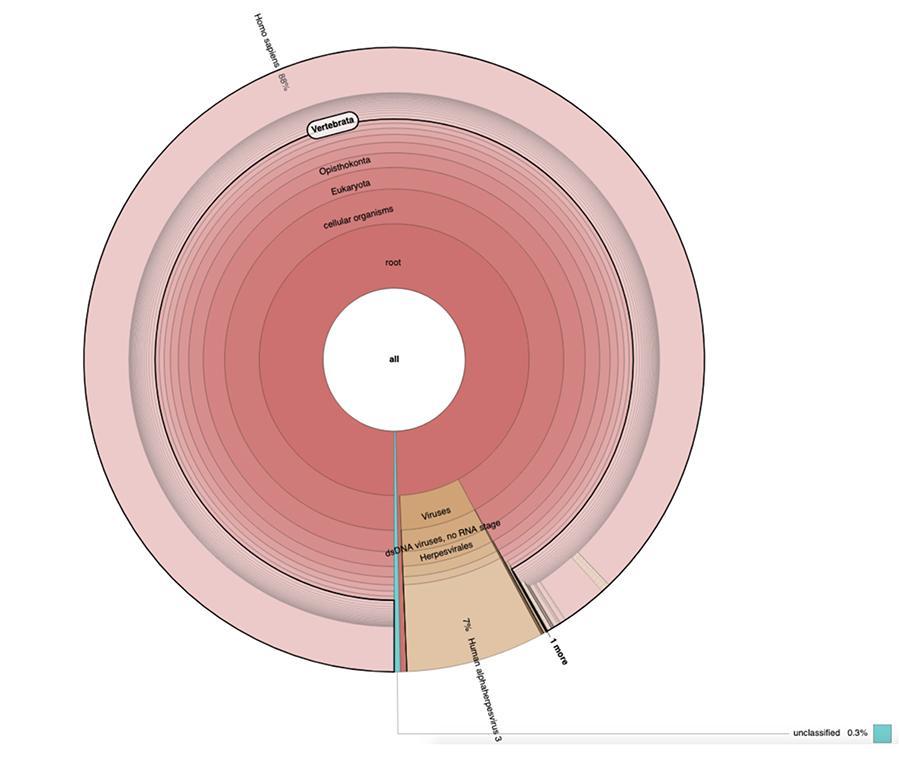
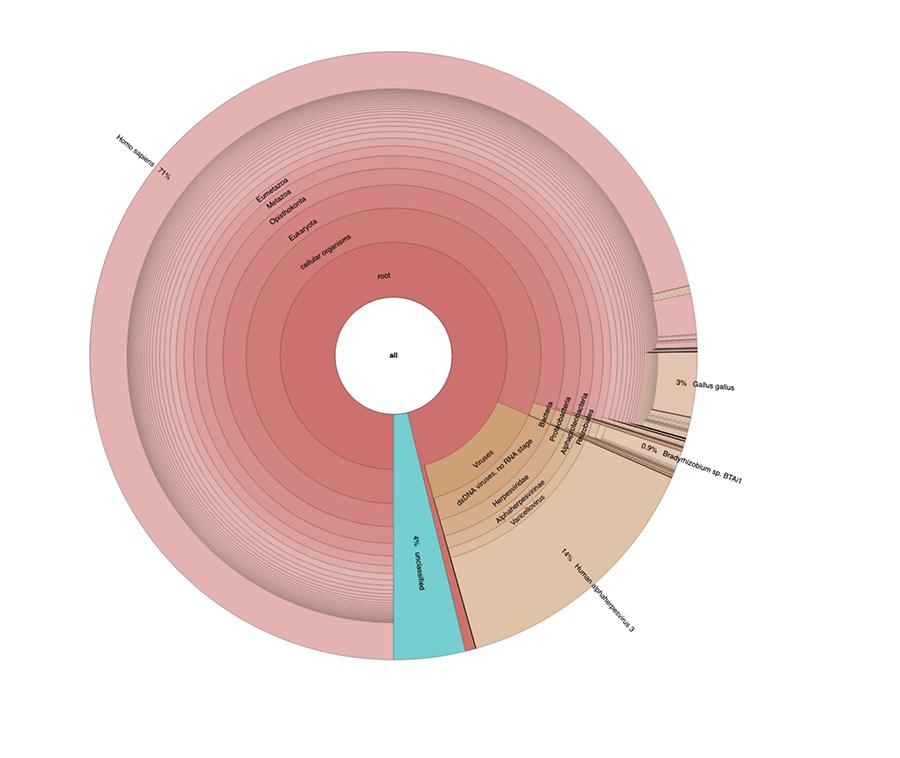
Outre les considérations et les conclusions auxquelles les travaux aboutissent, qui sont strictement techniques et donc compréhensibles uniquement pour ceux qui font des recherches dans le domaine de la métagénomique, ce qui est observé dans les camemberts contenus dans les `` données étendues '' (https://osf.io/wq395/ échantillons B1 et B2) est que les deux échantillons de vaccin contenaient un pourcentage élevé de lectures d'ADN humain en plus de celles attendues du génome du virus de la varicelle (virus alpha-herpès humain 3), le seul détectable parmi les quatre, étant dans l'article une analyse de type ADN-seq a été présentée.
71% des lectures dans un lot et 88% dans l'autre sont d'origine humaine, dérivant vraisemblablement de la lignée cellulaire d'origine fœtale MRC-5 (rappelez-vous que les analyses ultérieures ont confirmé que la ligne est MRC5) dans lesquels des virus vivants atténués de la rubéole et de la varicelle sont cultivés pendant la préparation du vaccin. De plus, comme cela s'est produit dans les différents lots du même vaccin MPRV testé par Corvelva entre 2017 et 2019, la quantité d'ADN extrait est de l'ordre du microgramme.
Dans les lots de vaccination testés avec les mêmes protocoles et technologies rapportés dans les matériaux et méthodes de l'article, les quantités détectées variaient entre 1 et près de 3 microgrammes par flacon, quantités variant d'un lot à l'autre, mais toujours significatives
Dans le rapport publié par Corvelva le 22.12.2018, les résultats suivants ont été rapportés pour d'autres lots analysés après ceux discutés dans l'article, puis confirmée par une analyse interlaboratoires toujours en cours de publication:
Lot Priorix Tetra. A71CB205A (juin 2018) - Analyse d'ADN
Lot Priorix Tetra. A71CB256A (décembre 2018) - Analyse d'ADN
Analyse ADN
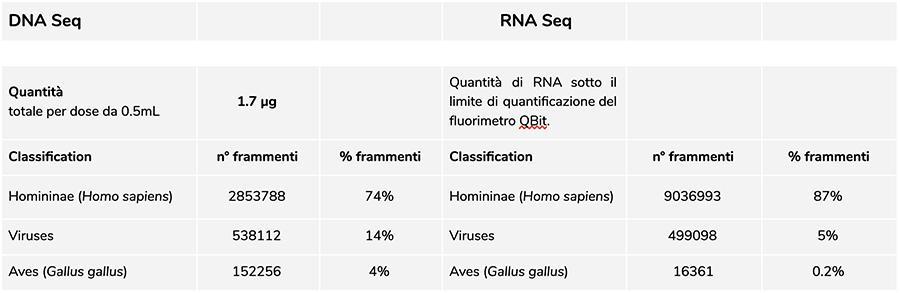
La mesure de la concentration de L'ADN avec le fluorimètre QuBit a montré que le lot A71CB205A contient une quantité de 1.7 µg d'ADNg totaux par dose de 0.5 ml, calculés comme suit: 9.41 ng / µl (concentration déterminée au QuBit) x 45 (volume final de remise en suspension d'ADN après extraction, exprimé en microlitres) x 4 (le volume de départ soumis à la procédure d'extraction est de ¼ le volume de la dose contenue dans le flacon entier égal à 0.5 ml).
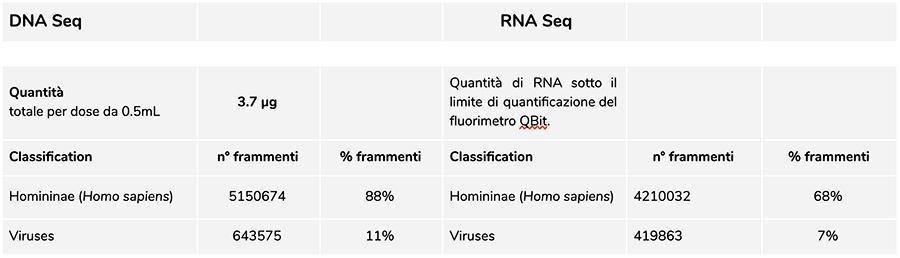
La mesure de la concentration de L'ADN avec le fluorimètre QuBit a montré que le lot A71CB256A contient une quantité de ADNg de 3.7 µg au total par dose de 0.5 ml, calculé comme suit: 40.8 ng / µl (concentration déterminée au QuBit) x 55 (volume final de remise en suspension d'ADN après extraction exprimé en microlitres) x 5/3 (le volume de départ soumis à la procédure d'extraction est de 300 µl sur 500 µl de suspension).
L'ADN humain trouvé dans ce lot a un rapport relatif d'environ 8 à 1 par rapport à l'ADN de la varicelle (voir les résultats suivants de la classification des fragments d'ADN-seq, dans lesquels il ressort que 88% du total des fragments d'ADN séquencés est de d'origine humaine et 11% du génome du virus de la varicelle). Étant donné que le NGS est une technologie quantitative, la quantification fluorimétrique de l'ADN total extrait du vaccin (par exemple lot A71CB256A = 3,7 microgrammes par dose), associée à la prise en compte de la quantification relative effectuée ci-dessus (8: 1), nous permet de dire que l'ADN humain pourrait être autour 2,9 microgrammes par dose, comparativement à environ 740 nanogrammes d'ADN de varicelle. Il est également plausible que au moins une partie de l'ADN de haut poids moléculaire qui est vu sur le gel peut être de l'ADN humain de haut poids moléculaire.
Analyse d'ARN
La quantité de ARN contenue dans le flacon du lot de vaccins A71CB256A s'est avérée être approximativement 200ng.
Le RIN égal à 8 indique un ARN d'excellente qualité et un ARN eucaryote intact, car les pics 18S et 28S typiques de l'ARN eucaryote sont présents.
Les réponses à nos questions transmises aux agences de régulation au fil du temps sont d'une grande importance. Actuellement, les agences n'ont pas encore répondu aux questions concernant les résultats des analyses complètes fournies à l'EMA et à l'AIFA.
Extrait de la réponse ema à notre question concernant l'innocuité des résidus mrc-5 dans le vaccin tetra priorix (demande de référence EMA ask-43967 3 août 2018) - «Sur la base des informations publiées, Priorix Tetra contient des souches virales produites séparément dans des cellules d'embryons de poulet (oreillons et rougeole) ou dans des cellules diploïdes humaines MRC-5 (rubéole et varicelle). Les lignées cellulaires utilisées pour Priorix Tetra comprennent des lignées cellulaires diploïdes humaines qui ne peuvent pas se diviser en continu. Notez que, selon la Pharmacopée européenne, les lignées de cellules diploïdes MRC-5 ne sont pas tumorigènes, comme le démontrent des décennies d'utilisation et de contrôle, et donc une limite maximale pour l'ADN des cellules MRC-5 ne s'applique pas "
À ce jour, aucune preuve n'a été apportée (ni en termes de certificats d'analyse sur la qualité du produit, ni de littérature scientifique de référence pour l'EMA) de ces contrôles qui garantissent qu'il convient de ne pas appliquer de limite maximale.
Dans la directive de la FDA "Guide pour l'industrie: caractérisation et qualification des substrats cellulaires et autres matériaux biologiques utilisés dans la production de vaccins viraux pour les indications de maladies infectieuses" 6 il est rapporté que:
- une souche de cellules diploïdes doit toujours rester diploïde. Si ces caractéristiques ne sont pas stables, il est nécessaire de démontrer que l'instabilité n'affecte pas négativement la production ou la conformité du produit.
- pour les souches de cellules diploïdes humaines largement utilisées, telles que les cellules MRC-5 et WI-38, la mesure de l'ADN résiduel peut ne pas être nécessaire car nous ne considérons pas que l'ADN résiduel de ces cellules diploïdes humaines soit un problème de sécurité
- L'ADN résiduel doit être limité pour les cellules continues non tumorigènes, telles que les cellules VERO passe-bas, moins de 10 ng / dose pour l'inoculation parentérale comme recommandé par l'OMS
Et dans la ligne directrice de l'OMS «Annexe 3 - Recommandations pour l'évaluation des cultures de cellules animales en tant que substrats pour la fabrication de médicaments biologiques et pour la caractérisation des banques de cellules. Remplacement de l'annexe 1 de la série OMS de rapports techniques, n. 878 " 7 nous ajoutons: (...) une expérience considérable a été accumulée sur la cytogénétique de WI-38 et MRC-5 depuis les années 60
et pour soutenir cette expérience, les articles suivants sont répertoriés:
- Jacobs JP. Résultats actualisés sur la caryologie des souches cellulaires WI-38, MRC-5 et MRC-9. Developments in Biological Standardization, 1976, 37: 155–156.
- Jacobs JP. et al. Lignes directrices pour l'acceptabilité, la gestion et les tests des cellules diploïdes humaines propagées en série pour la production de vaccins à virus vivants destinés à l'homme. Journal of Biological Standardization, 1981, 9: 331–342.
- Petricciani JC et al. Normes de caryologie pour la lignée cellulaire diploïde rhésus DBS-FRhL-2. Journal of Biological Standardization, 1976, 4: 43–49.
- Schollmayer et et al. Analyse haute résolution et condensation différentielle dans les chromosomes humains à bandes RBA. Human Genetics, 1981, 59: 187-193.
- Rønne M. Préparation des chromosomes et techniques de bandes à haute résolution: une revue. Journal of Dairy Science, 1989, 72: 1363–1377.
On constate clairement que la littérature de référence, pour affirmer que les cellules diploïdes utilisées pour la production de vaccins sont sûres du point de vue de la stabilité génétique, c'est obsolète. Il y a déjà 40 ans, les premières anomalies génétiques ont été découvertes, considérées comme négligeables pour la sécurité des vaccins, et d'après ce qui est rapporté dans les directives de l'OMS, depuis lors, aucune mise à jour n'a été faite avec les nouvelles technologies de séquençage, en particulier dans le NGS, qui est en outre économique. et rapide, avec pour conséquence que dans les vaccins administrés depuis des décennies, la présence d'ADN de plus en plus génétiquement modifié et en quantités incontrôlées est autorisée par les agences. À cet égard, voir le rapport sur le séquençage de l'intégralité du génome MRC-5 publié sur le site Internet de Corvelva le 27.09.2019. 8 dans laquelle la modification profonde de cet ADN est également évidente dans les gènes associés au développement de pathologies tumorales. (données en cours de publication)
Un extrait de la lettre du Dr T. Deisher, expert mondial de l'utilisation des cellules souches à des fins thérapeutiques et de thérapie génique, est signalé, qui souligne la préoccupation des risques associés à l'utilisation de vaccins contaminés par des résidus de cellules fœtales humaines:
Dr T. DEISHER (lettre aux dirigeants - 8 avril 2019) 9 - (...) injecter à nos enfants une contamination d'ADN fœtal humain comporte le risque de provoquer deux maladies bien établies:
- mutagenèse insertionnelle: L'ADN fœtal humain est incorporé dans l'ADN du bébé provoquant des mutations. La thérapie génique utilisant la recombinaison homologue de petits fragments a montré que des quantités aussi petites que 1,9 ng / mL de fragments d'ADN entraînent l'insertion de cellules souches dans le génome chez 100% des souris injectées. Les niveaux de fragments d'ADN fœtal humain chez nos enfants après vaccination avec les vaccins ROR, VARIVAX (varicelle) ou contre l'hépatite A atteignent des niveaux supérieurs à 1,9 ng / ml.
- maladie auto-immune: L'ADN fœtal humain stimule la réaction du système immunitaire pour attaquer le corps du bébé.
Nos résultats renforcent grandement les observations expérimentales du Dr Deisher et surtout le fait que l'ADN foetal contaminant présent dans tous les échantillons analysés en quantités variables (donc incontrôlées) est jusqu'à 300 fois la limite EMA pour l'ADN cancérigène (10 ng / dose, correspondant à l'ADN contenu dans environ 1000 cellules cancéreuses, obtenu sur la base d'un calcul statistique, alors que la limite de précaution est de 100 pg / dose) limite qui doit nécessairement s'appliquer également à l'ADN fœtal qui contamine inévitablement le Priorix Tetra.
Il s'ensuit que ce vaccin doit être considéré comme défectueux et potentiellement dangereux pour la santé humaine, en particulier dans la population pédiatrique beaucoup plus vulnérable aux dommages génétiques et auto-immunes dus à l'immaturité dans les systèmes d'hébergement.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate.html
https://www.corvelva.it/speciale-corvelva/vaccinegate-en.html - https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.federalregister.gov/documents/2010/03/04/2010-4553/guidance-for-industry-characterization-and-qualification-of-cell-substrates-and-other-biological
- https://www.who.int/biologicals/vaccines/TRS_978_Annex_3.pdf
- https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/approfondimenti/notizie/mondo/lettera-aperta-ai-legislatori-sul-dna-fetale-nei-vaccini-theresa-deisher.html

