Evaluación de la eficacia y eficiencia de las vacunas contra la influenza en niños sanos: revisión sistemática

The Lancet
Jefferson T, Smith S, Demicheli V, Harnden A, Rivetti A, Pietrantonj C
2005
Resumen
Antecedentes El objetivo fue evaluar la evidencia de la eficacia y la eficiencia de las vacunas vivas atenuadas e inactivadas contra la influenza en niños de hasta 16 años de edad.
Métodos Hemos revisado la Biblioteca Cochrane, MEDLINE, EMBASE Biological Abstracts y Science Citation Index desde junio de 2004, en cualquier idioma, y nos hemos puesto en contacto con fabricantes de vacunas y autores de estudios relevantes para identificar datos adicionales. Se incluyeron casos aleatorios, de cohortes y de control que comparaban la efectividad de las vacunas contra la influenza (reducción de casos confirmados por laboratorio), la eficacia de las vacunas contra la enfermedad similar a la influenza (reducción de casos sintomáticos), o ambas. , con placebo o sin intervención. Analizamos los siguientes resultados: gripe, enfermedad similar a la gripe, hospitalizaciones, ausencias escolares, complicaciones y transmisión secundaria.
Resultados Se incluyeron 14 ensayos controlados aleatorios, ocho estudios de cohortes, un estudio de casos y controles y un ensayo controlado aleatorio sobre el uso de vacunas intraepidémicas. Las vacunas vivas atenuadas contra la influenza son 79% efectivas y 38% efectivas en niños mayores de 2 años en comparación con placebo o inmunización. Las vacunas inactivadas tuvieron una eficacia menor (65%) que las vacunas vivas atenuadas y en niños de 2 años de edad o menos tuvieron efectos similares sobre el placebo. La eficacia de las vacunas inactivadas fue aproximadamente del 28% en niños mayores de 2 años.
Las vacunas fueron efectivas para reducir las ausencias prolongadas en la escuela (riesgo relativo 0-14 [IC 95% 0 · 07-0 · 27]). Los estudios que evaluaron los efectos de las vacunas contra casos secundarios, enfermedad del tracto respiratorio inferior, otitis media aguda y estancia hospitalaria no sugirieron ninguna diferencia con el placebo o el tratamiento estándar, pero carecieron de poder estadístico.
Interpretación Las vacunas contra la influenza (particularmente las vacunas vivas atenuadas de dos dosis) son efectivas en niños mayores de 2 años. La efectividad y la eficiencia de las vacunas difieren mucho. Solo dos estudios pequeños evaluaron los efectos de las vacunas contra la gripe en los ingresos hospitalarios y ningún estudio evaluó la reducción de la mortalidad, las complicaciones graves y la transmisión comunitaria de la gripe.
Si se recomienda la inmunización contra la gripe en niños como política de salud pública, se necesitan con urgencia estudios a gran escala que evalúen resultados tan importantes y realicen comparaciones directas de vacunas.
Introducción
Los esfuerzos para prevenir la propagación anual de la influenza se han centrado en el uso de vacunas. Hasta la fecha, las campañas de vacunación y cobertura se han dirigido a personas de 65 años o más. En una situación no pandémica, la elección de la estrategia preventiva consiste en la inmunización de ciertas categorías de población, por ejemplo, niños, ancianos, personas con enfermedades crónicas, trabajadores de la salud o toda la población.
La Academia Estadounidense de Pediatría y el Comité Asesor sobre Prácticas de Inmunización de los Centros para el Control y la Prevención de Enfermedades de EE. UU.1 (El Comité Consultivo de Vacunación de los Centros para el Control y la Prevención de Enfermedades de los Estados Unidos) ha recomendado que la vacunación contra la gripe en niños de entre 6 y 23 meses se instituya como una medida de salud pública a partir de la temporada de gripe. 2004-05. Una declaración de mayo de 2004 del Comité Asesor sobre Prácticas de Inmunización titulada Prevención y control de la influenza 2 (Prevención y control de la gripe) también recomienda que las personas en contacto cercano con bebés entre las edades de 0 y 23 meses se vacunen.
En Canadá, el Comité Nacional Asesor sobre Inmunización3 (Comité Asesor Nacional sobre Inmunización) hizo lo mismo en febrero de 2004. Los temas principales para extender la inmunización a niños sanos de entre 6 y 23 meses4 - 6 y los que asisten a la escuela6,7 incluir la reducción de: la cantidad de pacientes con influenza; el número de admisiones en exceso; la mortalidad de las personas mayores en familias con niños; contactos de atención médica (por ejemplo, médicos de familia); la cantidad de recetas de antibióticos; y absentismo para niños y convivientes.
El proceso lógico de toma de decisiones sobre la prevención de la influenza se complica por la ausencia de predicciones confiables sobre el efecto del virus y por las incertidumbres sobre los efectos de las vacunas en diferentes grupos de edad.
En una revisión Cochrane de vacunas contra la influenza en adultos sanos 8, se observó una diferencia notable entre la eficacia contra la influenza (reducción de casos confirmados por laboratorio) y la eficacia contra enfermedades similares a la influenza (reducción de casos sintomáticos) de vacunas. Una evaluación precisa de la efectividad y eficiencia de las vacunas contra la influenza es esencial para permitir una elección razonada entre estrategias alternativas.
El objetivo fue identificar y evaluar estudios comparativos que evalúen la efectividad y la eficiencia de las vacunas contra la influenza en niños sanos menores de 16 años.
Nuestro artículo es parte de una próxima revisión Cochrane más grande que incluye pruebas de seguridad de vacunas.9
Métodos e Investigaciones
Para identificar informes de estudios y revisiones sistemáticas, se realizaron búsquedas en las siguientes bases de datos electrónicas hasta finales de mayo de 2004: la Biblioteca Cochrane, incluida la base de datos Cochrane de revisiones sistemáticas, la Base de datos de resúmenes de revisiones de efectividad del NHS y el Registro central Cochrane de ensayos controlados (CENTRAL); MEDLINE (OVID, desde enero de 1966); EMBASE (Dialog ', 1974–79; SilverPlatter, desde 1980); Biological Abstracts (SilverPlatter, de 1969); y Science Citation Index (Web of Science, de 1974).
Hemos realizado investigaciones en cualquier idioma.
El detalle de la estrategia de búsqueda está disponible en el apéndice 1 de weba (http://image.thelancet.com/extras/04art9306webappendix1.pdf).
Para identificar estudios adicionales publicados y no publicados, se realizaron búsquedas en el índice de citas científicas para identificar artículos que citan estudios relevantes. También incluimos estos estudios en PubMed y utilizamos la función Artículos relacionados. Evaluamos las bibliografías de todos los artículos relevantes obtenidos y las revisiones publicadas para estudios posteriores. Para cualquier aclaración, contactamos a los propios fabricantes de vacunas o a los autores correspondientes del estudio.
Selección
Seleccionamos ensayos clínicos aleatorios, estudios de cohortes y estudios de casos y controles (apéndice 2; http://image.thelancet.com/extras/04art9306webappendix2.pdf) para la evaluación de la inmunización de niños de 16 años y menores en cualquier posición geográfica con cualquier vacuna contra la gripe administrada de forma independiente, en cualquier dosis, preparación u horario, en comparación con placebo o sin ninguna intervención.
Se decidió incluir evidencia de estudios comparativos no aleatorios para mejorar la relevancia de la revisión.
Se consideraron las siguientes medidas de resultado primarias en la selección de estudios: eficacia y eficiencia preventivas; casos de influenza confirmados por aislamiento viral, apoyo serológico, cualquier otro tipo de prueba de laboratorio para identificación viral (casos de influenza) o una combinación de estos; casos de enfermedades similares a la gripe dentro de 1 año de la vacunación; hospitalizaciones por enfermedades similares a la gripe o gripe; muertes (debido a una enfermedad similar a la gripe o gripe); y cualquier otro indicador directo o indirecto del impacto de la enfermedad. No consideramos los datos de resultados serológicos porque nuestro objetivo era evaluar la evidencia del impacto de la inmunización en la salud pública.
Extracción de datos y evaluación de la validez del estudio.
Dos de nosotros (SS y AR) aplicamos independientemente los criterios de inclusión a todos los artículos identificados y recuperados y luego extrajeron los datos de los estudios incluidos en los formularios estándar del Campo de vacunas Cochrane. El procedimiento fue supervisado y arbitrado por TJ y VD.
Se evaluó la calidad metodológica de los ensayos controlados aleatorios con criterios del manual del revisor Cochrane.10 Se evaluaron los estudios según la asignación al azar, la generación de secuencias y el ocultamiento de la asignación, los estudios cegados y los estudios posteriores. Se evaluó la calidad de los estudios no aleatorios en relación con la presencia de posibles factores de confusión. Utilizamos las escaleras Newcastle-Ottawa para evaluar los estudios.11
Debido a la falta de evidencia empírica sobre el efecto que tiene la calidad metodológica en los resultados de los estudios no aleatorios, utilizamos la calidad en la fase de análisis como un medio para interpretar los resultados mediante un análisis gradual de sensibilidad. Los detalles completos sobre la evaluación de la calidad están disponibles del autor correspondiente.
Ingresamos los datos extraídos en el software Cochrane RevMan (versión 4.2, Cochrane Collaboration, Oxford, Reino Unido). La agregación de los datos dependía de la sensibilidad y la homogeneidad de las definiciones de exposición, poblaciones y resultados utilizados. Cuando los estudios fueron homogéneos, realizamos un metanálisis dentro de cada categoría de proyecto. Hemos resumido las estimaciones de eficiencia y efectividad como riesgo relativo con IC del 95%. La efectividad de la vacuna absoluta se calculó como 1 menos el riesgo relativo y se expresó como un porcentaje.
Nos embarcamos en un análisis sensorial gradual al excluir de nuestro metaanálisis los estudios realizados en la antigua Unión Soviética. También hicimos un análisis de subgrupos cuando los datos estaban disponibles por tipo de vacuna administrada, edad de los individuos y especificidad de las definiciones de los resultados.
La estratificación por edad (≤2 años, ≤6 años y> 6 años) indica la estratificación más común informada en los estudios incluidos. Para evaluar el efecto sobre la heterogeneidad estadística, se calculó I2 para cada estimación agregada.12 Esta estadística se puede interpretar como la proporción de la variación total entre las estimaciones del efecto que es atribuible a la heterogeneidad en lugar del error de muestreo y es intrínsecamente independiente del número de estudios. Cuando yo2 es inferior al 30%, existe poca preocupación por la heterogeneidad estadística.12 - 14 Utilizamos modelos de efectos aleatorios para explicar la varianza del estudio en nuestros hallazgos.15
Papel de la fuente de financiación.
El patrocinador no tuvo ningún papel en el diseño del estudio, la recopilación de datos, el análisis de datos, la interpretación de datos o la redacción de informes. El autor tenía acceso completo a todos los datos del estudio y, en última instancia, era responsable de la decisión de enviar para su publicación.
Resultados
De los 1204 títulos identificados por nuestra investigación, seleccionamos y recuperamos 125 informes de estudios que podrían cumplir con los criterios de inclusión (figura 1). Se han excluido 100 informes. La razón más frecuente de exclusión fue la falta de controles independientes (n = 29) y el diseño no comparativo (n = 15). Una lista completa con motivos de exclusión está disponible a solicitud del autor.
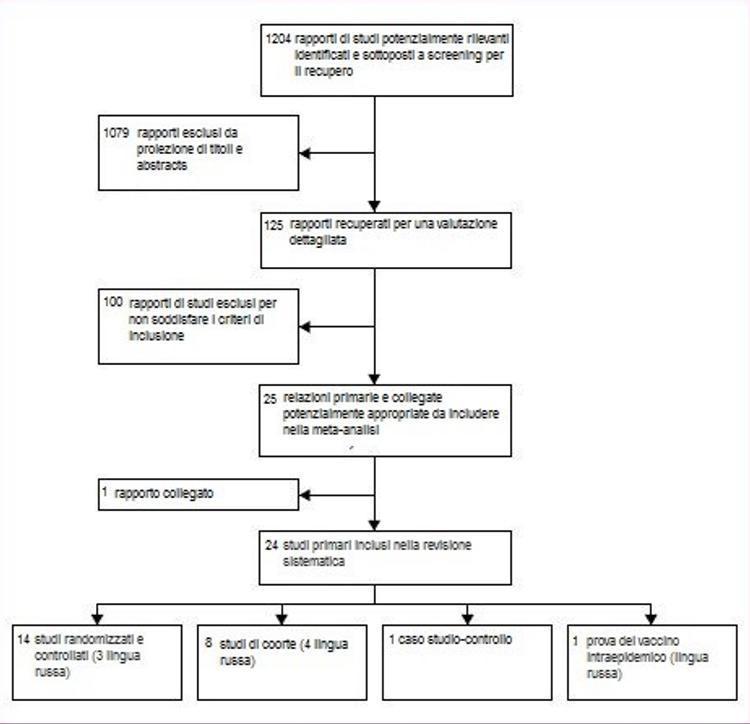
Figura 1: flujo de estudios analizados
La Tabla 1 proporciona una sinopsis de los estudios incluidos. De los 25 informes incluidos, 14 eran de ensayos controlados aleatorios;16 - 29 También identificamos un estudio aleatorizado sobre el uso intraepidémico de la vacuna viva administrada por vía oral.30 Nueve informes fueron de ocho estudios de cohortes:31 - 39 una relación32 fue un nuevo análisis de un estudio previo31 con más datos y, por lo tanto, consideramos las publicaciones dos informes del mismo estudio. Un informe cubrió un estudio de casos y controles.40 Tres de los ensayos aleatorizados.22,29,30 y cinco informes de estudio de cohortes31-34,39 Han sido traducidos del ruso. Dos de estos31-33 se clasificaron como estudios de cohorte porque la aleatorización no se había mencionado en el texto.
En seis estudios aleatorizados, controlados con placebo, la influenza se informó como una medida de resultado (denominador combinado 5052) 17 - 20,23,24 Otros hallazgos fueron enfermedades similares a la influenza en cuatro informes (93 023), 16,20,23,28 síntomas de infección de las vías respiratorias superiores en otros cuatro (29 498), 20,22,23,28 casos secundarios (infectados por contactos) en uno (123), 23 ausencias de la escuela en otro (550), 25 dos enfermedades del tracto respiratorio inferior (1550), 18,20 otitis media aguda en tres (2298), 18,20,24 y consecuencias de la otitis media aguda en uno (765).24 Ninguno de los tres ensayos controlados aleatorios con un grupo sin intervención tuvo influencia como medida de resultado. Una enfermedad similar a la gripe fue el resultado de dos informes (denominador combinado 67 324), 21,29 ausencias de la escuela por más de 4 días y otitis media aguda habían resultado en un estudio (344), 21 y el impacto socioeconómico (enfermedad respiratoria febril, número de días de hospitalización y días escolares perdidos) fue el resultado en otro informe (303).26 La influencia fue una medida de resultado para cuatro estudios de cohortes (denominador combinado 1912) 33,36 - 38 y la enfermedad similar a la gripe fue uno de cada seis estudios (8593).31 - 36,39 En la evaluación de validez, dos estudios obtuvieron puntajes altos en todos los criterios.17,24 Nueve ensayos tuvieron una asignación al azar adecuada17-19,21,24-26,28,30 y en los seis restantes, la asignación al azar fue inadecuada o poco clara. La asignación se ocultó adecuadamente en seis de los estudios controlados con placebo.16,17,19,23,24,27 Ocho estudios documentaron pérdidas de seguimiento17,19,20,23 - 25,28,30 y se han proporcionado datos suficientes en estos informes para permitirnos emprender un análisis por intención de tratar (ITT: análisis de los resultados de un experimento que se basa en la asignación inicial del tratamiento y no en el tratamiento finalmente recibido). Dos estudios de cohortes obtuvieron puntajes altos en todos los ítems.33,37 El estudio de casos y controles se realizó e informó adecuadamente, pero no se proporcionaron los odds ratios (Odds Ratio es la medida de la asociación entre dos factores, por ejemplo, entre un factor de riesgo y una enfermedad).40
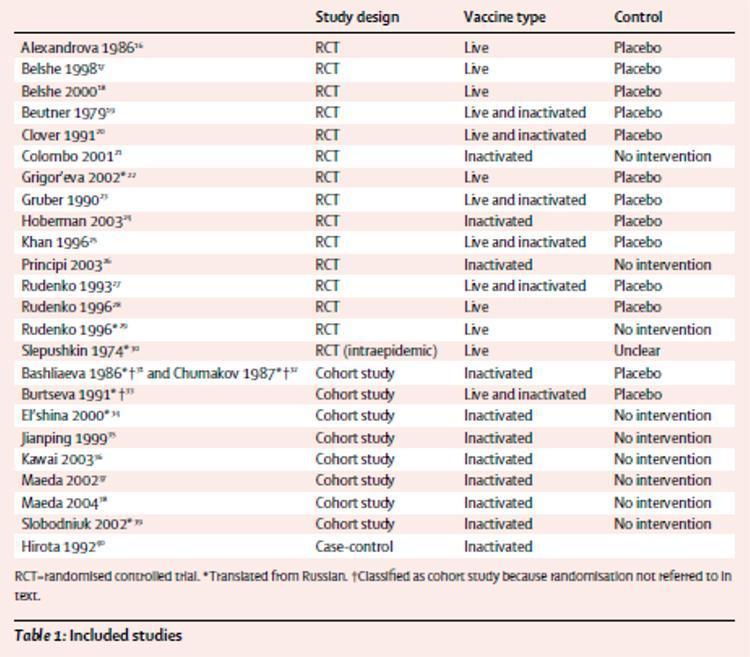
Tabla 1: estudios analizados
Realizamos cinco comparaciones principales en nuestro metanálisis: tres ensayos incluidos de ensayos controlados aleatorios (comparaciones 1-3) y dos datos de estudios de cohortes. Las comparaciones 1 y 4 incluyeron resultados para vacunas vivas atenuadas, mientras que las comparaciones 2 y 5 utilizaron datos para vacunas inactivadas. Todos los comparadores fueron placebo o ninguna intervención y las comparaciones 1, 2, 4 y 5 fueron estratificadas por grupos de edad disponibles) y tipo de resultado (influenza, comparaciones 1, 2, 4, 5; enfermedad similar a la gripe, comparaciones 1a, 2do 4to, 5to). La comparación 3 incluyó datos relacionados con los resultados del impacto (casos secundarios, ausencias escolares, enfermedad del tracto respiratorio inferior, otitis media aguda y sus consecuencias y estancia hospitalaria). Debido a la escasez de datos (la mayoría de los resultados se informaron de solo uno o dos estudios), no fue posible establecer una edad o una estratificación para la comparación 3. La Figura 2 ilustra la evaluación de la eficacia de la vacuna . En la comparación 1, las vacunas vivas atenuadas tuvieron una eficacia general del 79%, aunque no se registraron datos utilizables en niños de 2 años o menos. En un estudio de 1602 niños de 15 a 71 meses, las estimaciones de eficacia de la vacuna se informaron en la sección de discusión del 86% (IC 95% 65-94) en niños de 1 año y 96% (86-99 ) en niños de 2 años 1.17 Sin un desglose por edad, estos datos no pueden incluirse en el metanálisis. La comparación 2 mostró que las vacunas inactivadas fueron 65% efectivas, lo cual es menor que las vacunas vivas atenuadas, aunque la diferencia no es significativa. En niños de 2 años y menores, las vacunas inactivadas no fueron más efectivas que el placebo (24%), aunque esta observación se basó en un pequeño estudio.24 En la comparación 4, las vacunas vivas atenuadas fueron 44% efectivas, aunque esta observación se basó una vez más en los resultados de un pequeño estudio.33 La comparación 5 mostró que las vacunas inactivadas tenían una eficacia del 64% en niños mayores de 6 años, 66% en los de 6 años o menos y no eran mejores que el placebo (37%) en niños de 2 años o menos.
La Figura 2 también describe la evaluación de la efectividad de la vacuna. En la comparación 1a, las vacunas vivas atenuadas tenían un 38% de eficacia general, pero no encontramos evidencia en niños de 2 años o menos. La comparación 2a mostró que las vacunas inactivadas tenían un 28% de eficacia general; de nuevo, no encontramos evidencia en niños de 2 años o menos. En la comparación 4a, las vacunas vivas atenuadas no fueron efectivas en niños mayores de 6 años, aunque esta observación se basó en un estudio.33 No encontramos evidencia para esta comparación en los otros grupos de edad. La comparación 5a mostró que las vacunas inactivadas tienen una efectividad general del 57%, pero una vez más no pudimos encontrar datos en niños de 2 años o menos. Estas vacunas no son efectivas en niños de 6 años o menos, pero en los mayores de 6 años, fueron 58% efectivas.
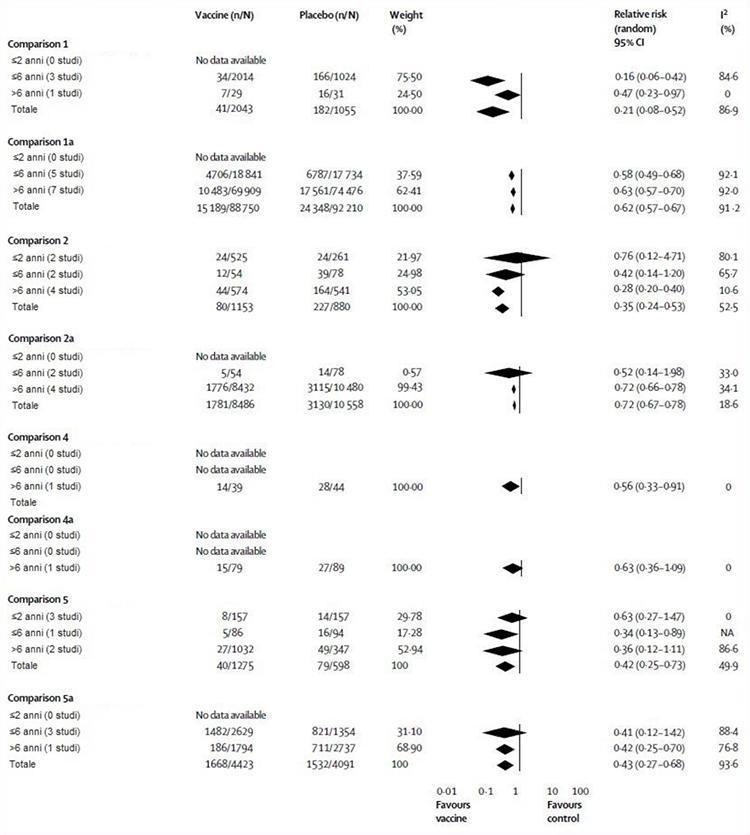
Figura 2: Vacuna contra la influenza viva atenuada e inactivada en comparación con placebo o ninguna intervención por edad y plan de estudio
NA = No aplicable.
El estudio de casos y controles probó la eficacia contra la enfermedad similar a la gripe de una vacuna inactivada durante un brote en 803 niños de entre 6 y 12 años.40 La vacuna estaba bien equilibrada antigénicamente con la cepa circulante y su administración estaba inversamente asociada con el riesgo de enfermedad grave pero no leve similar a la gripe.
La Figura 3 ilustra la evaluación de la evidencia de ensayos controlados aleatorios de la eficacia de la vacuna sobre los resultados del impacto. Las vacunas fueron significativamente más efectivas que el placebo o ninguna intervención para reducir las ausencias escolares, pero ambas observaciones se basaron en un estudio.21,25 En un tercer estudio, 26 Se registró una caída significativa en los días escolares perdidos por los niños inmunizados en comparación con los niños no tratados. Los efectos de las vacunas en todos los demás resultados (casos secundarios, enfermedad del tracto respiratorio inferior, otitis media aguda y sus consecuencias y estancia hospitalaria) no difirieron significativamente de los del placebo o cualquier intervención (Figura 3).
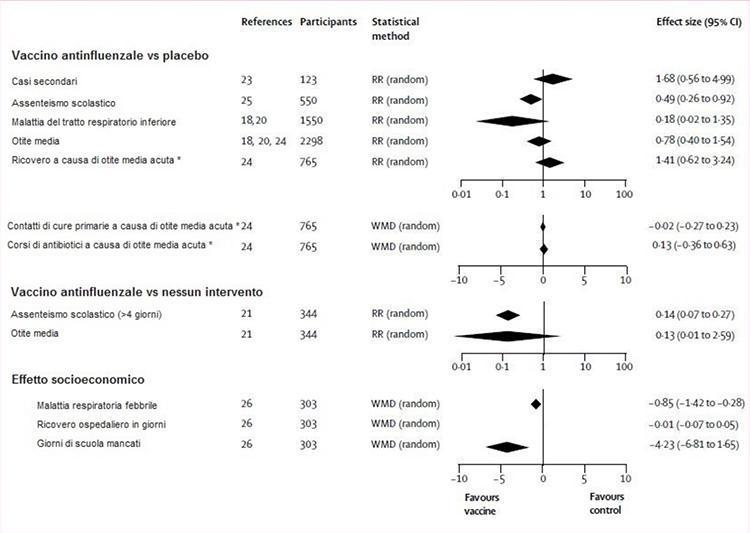
Figura 3: vacuna contra la gripe versus placebo o ninguna intervención
RR (aleatorio) = riesgo relativo (modelo de efecto aleatorio). DMA (aleatorio) = diferencia de peso promedio (modelo de efecto aleatorio). * Vacuna inactivada, dos dosis.
La comparación entre la eficacia de la dosis única y los modelos de dos dosis de vacunas vivas atenuadas en comparación con placebo favoreció el programa de dos dosis (73% de eficacia 17,18,20,23 frente al 93% 17), aunque la estimación para el programa de dos dosis se basa en un solo estudio. Se usó un programa de dosis única en todos los estudios de vacunas inactivadas.19,20,23,24. Los datos de agrupación para todos los grupos de edad no hicieron ninguna diferencia en nuestras conclusiones.
La Tabla 2 muestra los resultados de la sensibilidad progresiva del análisis. Todas las comparaciones, excepto las comparaciones 1 y 2, fueron sensibles a la exclusión de evidencia de los estudios realizados en la antigua URSS. En la comparación 1a, la exclusión de seis conjuntos de datos independientes hizo que la estimación de la eficacia fuera insignificante en niños mayores de 6 años, pero aumentó la eficacia total del 38% al 67%. En la comparación 2a, las estimaciones de eficacia para niños mayores de 6 años no se vieron significativamente afectadas, pero aumentaron del 28% al 76%. Las comparaciones 4 y 4a se han despoblado mediante la eliminación de un conjunto de datos en cada capa. En la comparación 5, la estimación no significativa del 64% para niños mayores de 6 años se volvió significativa (80%), mientras que en la comparación 5a, las estimaciones para los mayores de 6 años (58%) se mantuvieron significativas. pero aumento de tamaño (90%).
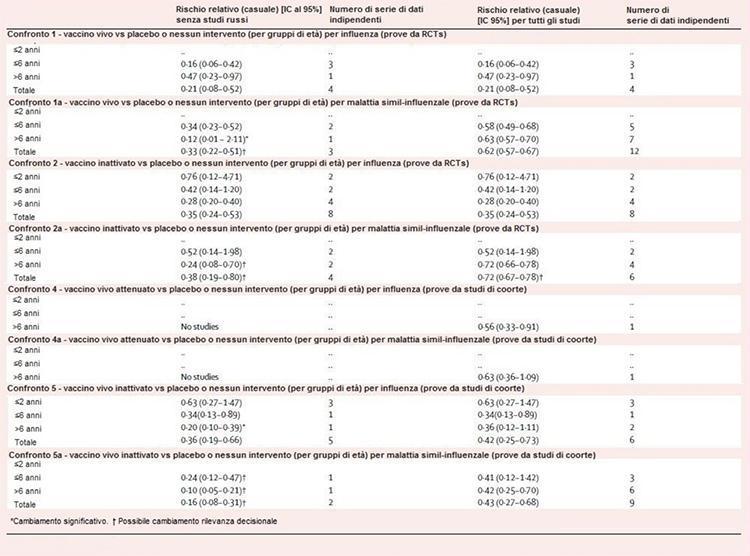
Tabla 2: sensibilidad del análisis
Hilo
Hemos demostrado que las vacunas vivas atenuadas contra la gripe tienen buena eficacia pero baja eficiencia en niños mayores de 2 años. Estas vacunas pueden ser adecuadas para controlar un brote escolar; sin embargo, no están autorizados para su uso en niños menores de 2 años. Las vacunas inactivadas tuvieron menor eficacia que las vacunas vivas atenuadas y en niños de 2 años de edad o menos tuvieron efectos similares al placebo. Su eficiencia fue baja en niños mayores de 2 años; No hemos encontrado evidencia por 2 años o menos. Nuestras conclusiones sobre las vacunas inactivadas se basan en más de 18 000 observaciones de ensayos aleatorios. Los resultados de los estudios de cohortes (5910 observaciones) sugirieron que las vacunas inactivadas tenían una alta eficacia y eficiencia en niños mayores de 6 años, pero en aquellos menores de 2 años, la eficacia no fue mejor que el de placebo y no hubo evidencia de su eficacia. Las diferencias entre la eficacia y la eficiencia de la vacuna no son sorprendentes porque las vacunas contra la gripe están específicamente dirigidas a los virus de la gripe y no están diseñadas para prevenir otras causas de enfermedades similares a la gripe.
Hemos encontrado poca evidencia para otros resultados. Las vacunas fueron algo efectivas para reducir la ausencia escolar, pero tuvieron poco efecto en otros resultados (casos secundarios, enfermedad del tracto respiratorio inferior, otitis media aguda y sus consecuencias y estancia hospitalaria) en comparación con placebo o ninguna intervención. Sin embargo, estas conclusiones se basan en pocos estudios.
Raramente se han incluido estudios de Rusia en la discusión de este tema. Nuestro informe incluyó siete estudios traducidos del ruso. La exclusión de estos estudios de la antigua URSS no afectó sustancialmente nuestras conclusiones, pero hizo que nuestras estimaciones fueran más inestables. No tenemos motivos para creer que las vacunas producidas en la antigua Unión Soviética funcionen de manera diferente a sus homólogos occidentales. El único estudio controlado con placebo que compara directamente la eficacia de la vacuna de virus dividido trivalente inactivado con la vacuna de influenza trivalente viva atenuada y adaptada al frío en ausencias escolares, no mostró diferencias en el rendimiento.25
Nuestro análisis tiene varias limitaciones potenciales. Primero, no hemos podido encontrar datos suficientes para permitirnos sacar conclusiones definitivas sobre las vías de inmunización (intramuscular o intranasal) o sobre los programas de una o dos dosis de vacunas inactivadas. En segundo lugar, nuestro metanálisis encontró una heterogeneidad significativa, que podría atribuirse a varios factores. Por ejemplo, las diferencias entre los períodos de seguimiento del estudio (cuanto más largo sea el seguimiento, menor será la posibilidad de identificar casos con vacunas debilitadas, como la circulación viral), las definiciones de casos de enfermedades similares a la gripe (nuestro análisis de sensibilidad no mostró diferencias en la especificidad de la definición del caso), el rendimiento de las vacunas vivas, la búsqueda de casos y la calidad del estudio y las concentraciones de circulación del virus podrían haber causado heterogeneidad. Finalmente, los estudios incluidos proporcionaron datos insuficientes para estratificar la circulación viral o la duración del seguimiento, pero no creemos que la heterogeneidad haya afectado nuestras conclusiones porque nuestras estimaciones son inequívocas y todas apuntan a una alta eficacia y pobre eficacia de la vacuna.
La calidad metodológica general de los estudios incluidos fue razonable, aunque observamos que la descripción del contenido de la vacuna era variable y no se informaron conservantes ni excipientes. Podemos encontrar pocos comentarios sobre la calidad de la medida entre las vacunas utilizadas en los estudios, la cepa circulante y la composición de las vacunas recomendadas por la OMS. En adultos sanos, la composición antigénica es un predictor importante de la eficacia de la vacuna.8 La relativa escasez de comparaciones directas de vacunas evita consideraciones significativas sobre su rendimiento relativo y establece un requisito absoluto para futuros estudios de comparación directa.
En conclusión, identificamos un gran conjunto de datos que muestra evidencia de una calidad razonable de la eficacia de las vacunas contra la influenza en niños de 2 años de edad o mayores, especialmente para las vacunas vivas atenuadas de dos dosis. Sin embargo, hemos notado una diferencia notable entre la eficacia y la eficiencia de la vacuna debido a la gran proporción de enfermedades similares a la gripe causadas por agentes distintos de los virus de la gripe, un hallazgo que concuerda con una revisión Cochrane de vacunas contra la gripe en adultos sanos.8
Este punto es importante en la decisión de inmunizar a poblaciones enteras. Nuestros hallazgos no respaldan las vacunas de niños muy pequeños. Aunque un creciente cuerpo de evidencia apunta al efecto de la influenza en las hospitalizaciones y muertes de niños, no hemos encontrado evidencia convincente de que las vacunas puedan reducir la mortalidad, las hospitalizaciones, las complicaciones graves y la transmisión de la influenza en la comunidad infantil.
Riferencias
1. Comité de la Academia Americana de Pediatría sobre Enfermedades Infecciosas. Recomendaciones para la vacunación contra la gripe en niños. Pediatría 2004; 113: 1441-47.
2. Harper SA, Fukuda K, Uyeki TM, Cox NJ, Bridges CB. Prevención y control de la gripe: recomendaciones del Comité Asesor sobre Prácticas de Inmunización (ACIP). MMWR recomm Rep 2004; 53 (RR-6): 1-40.
3. Orr P. Declaración sobre la vacunación contra la influenza para la temporada 2004–2005. Poder Comun Representante Dis 2004; 30: 1-32.
4. Neuzil KM, Mellen BG, Wright PF, Mitchel EF Jr, Griffin MR. El efecto de la gripe en las hospitalizaciones, visitas ambulatorias y cursos de antibióticos en niños. N inglés JM Med 2000; 342: 225-31.
5. Izurieta HS, Thompson WW, Kramarz P, et al. Influencia y tasas de hospitalización por enfermedad respiratoria en lactantes y niños pequeños. N inglés JM Med 2000; 342: 232-39.
6. Principios N, Esposito S. ¿Estamos preparados para la vacunación universal contra la influenza en pediatría? Lancet Infect Dis 2004; 4: 75-83.
7. Reichert TA, Sugaya N, Fedson DS, Glezen WP, Simonsen L, Tashiro M. La experiencia japonesa con la vacunación de escolares contra la gripe. N inglés JM Med 2001; 344: 889-96.
8. Demicheli V, Remaches D, Deeks JJ, Jefferson TO. Vacunas para prevenir la gripe en adultos sanos (Revisión Cochrane traducida). Base de datos Cochrane Syst Rev 2004; 3: CD001269.
9. Smith S, Demicheli V, Jefferson T, Harnden A, Matheson N, Di Pietrantonj C. Vacunas para prevenir la influenza en niños sanos (Protocolo para una revisión Cochrane). Base de datos Cochrane Syst Rev 2004; 3: CD004879.
10. Alderson P, Green S, Higgins JPT. Sección 6, evaluación de la calidad del estudio - Manual de revisores Cochrane, 4.2.2 [actualizado en marzo de 2004]. http://www.cochrane.org/cochrane/handbook/hbook.htm (consultado el 18 de enero de 2005).
11. Wells GA, Shea B, O'Connell D, et al. La Escala de Newcastle-Ottawa (NOS) para evaluar la calidad de los estudios no aleatorios en metaanálisis. http://www.ohri.ca/programs/clinical_epidemiology/ oxford.htm (consultado el 18 de enero de 2005).
12. Higgins JP, Thompson SG. Cuantificación de la heterogeneidad en un metaanálisis. estadística médica 2002; 21: 1539-58.
13. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Medición de inconsistencia en metanálisis. BMJ 2003; 327: 557-60.
14. Deeks JJ, Higgins JPT, Altman DG. Sección 8, análisis y presentación de resultados. En: Alderson P, Green S, Higgins J, eds. Manual del revisor Cochrane 4.2.2 [actualizado en marzo de 2004]. http://www.cochrane.org/cochrane/handbook/hbook.htm (consultado el 18 de enero de 2005).
15. DerSimonian R, Laird N. Metaanálisis en ensayos clínicos. Control Clinica Pruebas 1986; 7: 177-88.
16. Alexandrova GI, Budilovsky GN, Koval TA, et al. Estudio de la vacuna viva recombinante de influenza bivalente adaptada al frío de tipo A para uso en niños: un ensayo de control epidemiológico. Vacune 1986; 4: 114-18.
17. Belshe RB, Mendelman PM, Treanor J, et al. La eficacia de la vacuna viva atenuada, adaptada al frío, trivalente, contra el virus de la influenza intranasal en niños. N inglés JM Med 1998; 338: 1405-12.
18. Belshe RB, Gruber WC, Mendelman PM, et al. Eficacia de la vacunación con la vacuna viva atenuada, adaptada al frío, trivalente e intranasal contra una variante (A / Sydney) no contenida en la vacuna. J Pediatra 2000; 136: 168-75.
19. Beutner KR, Chow T, Rubi E, Strussenberg J, Clement J, Ogra PL. Evaluación de una vacuna contra el virus de la influenza A específica de neuraminidasa en niños: respuestas de anticuerpos y efectos sobre dos brotes posteriores de infección natural. J Infect Dis 1979; 140: 844-50.
20. Clover RD, Crawford S, Glezen WP, Taber LH, Matson CC, Couch RB. Comparación de la protección heterotípica contra la gripe A / Taiwán / 86 (H1N1) por vacunas atenuadas e inactivadas con virus similares a A / Chile / 83. J Infect Dis 1991; 163: 300-04.
21. Colombo C, Argiolas L, La Vecchia C, Negri E, Meloni G, Meloni T. Vacuna contra la influenza en niños preescolares sanos. Rev epidemiología Sante público 2001; 49: 157-62.
22. Grigor'eva EP, Desheva I, Donina SA, et al. Las características comparativas de la seguridad, la actividad inmunogénica y la potencia profiláctica de los tipos adultos y niños de vacunas vivas contra la influenza en escolares de 7 a 14 años [en ruso]. Vopr virusol 2002; 47: 24-27.
23. Gruber WC, Taber LH, Glezen WP, y col. Vacuna contra la influenza viva atenuada e inactivada en niños en edad escolar. Soy J Dis Child 1990; 144: 595-600.
24. Hoberman A, Greenberg DP, Paradise JL, et al. Efectividad de la vacuna inactivada contra la influenza en la prevención de la otitis media aguda en niños pequeños: un ensayo controlado aleatorio. JAMA 2003; 290:1608-16.
25. Khan AS, Polezhaev F, Vasiljeva R, y col. Comparación de virus divididos inactivados en EE. UU. Y vacunas rusas atenuadas contra la gripe trivalente adaptadas al frío en escolares rusos. J Infect Dis 1996; 173: 453-56.
26. Principi N, Esposito S, Marchisio P, Gasparini R, Crovari P. Impacto socioeconómico de la gripe en niños sanos y sus familias. Pediatra Infectar Dis J 2003; 22 (supl 10): S207 – 10.
27. Rudenko LG, Slepushkin AN, Monto AS, et al. Eficacia de las vacunas vivas atenuadas e inactivadas contra la gripe en escolares y sus contactos no vacunados en Novgorod, Rusia. J Infect Dis 1993; 168: 881-87.
28. Rudenko LG, Lonskaya NI, Klimov AI, Vasilieva RI, Ramirez A. Evaluación clínica y epidemiológica de una vacuna contra la gripe viva y adaptada al frío para niños de 3 a 14 años. Toro Órgano Mundial de la Salud 1996; 74: 77-84.
29. Rudenko LG, Vasil'eva RI, Ismagulov AT, et al. Efectividad profiláctica de una vacuna viva recombinante contra la influenza tipo A en la inmunización de niños de 3 a 14 años [en ruso]. Vopr virusol 1996; 41: 37-39.
30. Slepushkin AN, Dukova VS, Kalegaeva VA, Kagan AN, Temriuk EE. Resultados de estudiar la efectividad de una vacuna viva contra la influenza para uso perioral en preescolares y escolares [en ruso]. Zh Microbiol epidemiología Inmunobiol 1974; 12: 24-29.
31. Bashliaeva ZA, Sumarokov AA, Nefedova LA, Iaroshevskaia II, Ozeretskovskaia NA. Resultados básicos de un ensayo del comité de la nueva vacuna Grippovac SE-AZh [en ruso]. Zh Microbiol epidemiología Inmunobiol 1986; 2: 49-54.
32. Chumakov MP, Boiko VM, Malyshkina LP, Mel'nikova SK, Rodin VI. Resultados de los ensayos codificados de la actividad de la vacuna contra la gripe de la subunidad trivalente Grippovak en jardines de infantes de Moscú en diciembre de 1983 hasta el primer trimestre de 1 [en ruso]. Vopr virusol 1987; 32: 175-83.
33. Burtseva EI, Obrosova-Serova NP, Govorkova EA, et al. Un estudio comparativo de las propiedades protectoras de las vacunas vivas recombinantes e inactivadas contra la influenza hechas de la cepa A / Filipinas / 2/82 (H3N2) en niños de 8 a 15 años [en ruso]. Vopr virusol 1991; 36: 375-77.
34. El'shina GA, Gorbunov MA, Bektimirov TA, et al. La evaluación de la reactogenicidad, inocuidad y eficacia profiláctica de la vacuna trivalente contra la gripe de la subunidad polimérica Grippol administrada a escolares [en ruso]. Zh Microbiol epidemiología Inmunobiol 2000; 2: 50-54.
35. Jianping H, Xin F, Changshun L, et al. Evaluación de la efectividad de Vaxigrip. Vacune 1999; 17 (supl 1): S57 – 58.
36. Kawai N, Ikematsu H, Iwaki N, et al. Un estudio prospectivo basado en Internet sobre la efectividad y la seguridad de la vacunación contra la influenza en la temporada de influenza 2001–2002. Vacune 2003; 21: 4507-13.
37. Maeda T, Shintani Y, Miyamoto H, et al. Efecto profiláctico de la vacuna antigripal inactivada en niños pequeños. Pediatra Int. 2002; 44: 43-46.
38. Maeda T, Shintani Y, Nakano K, Terashima K, Yamada Y. Fracaso de la vacuna inactivada contra la influenza A para proteger a los niños sanos de 6 a 24 meses. Pediatra Int. 2004; 46: 122-25.
39. Slobodniuk AV, Romanenko VV, Utnitskaia OS, Motus TM, Pereverzev AV. Influencia de la multiplicidad de inmunizaciones de niños con vacuna inactivada contra la influenza en la respuesta inmune y la efectividad de la protección [en ruso]. Zh Microbiol epidemiología Inmunobiol 2002; 4: 36-39.
40. Hirota Y, Takeshita S, Ide S, et al. Varios factores asociados con la manifestación de una enfermedad similar a la gripe. Int. J epidemiología 1992; 21:574-82.
fuente: www.ncbi.nlm.nih.gov/pubmed/15733718
Traducción de Valentina Sbrana, Cliva Tuscany

