¿Puede la vacuna antineumocócica causar lesiones y/o la muerte?

NOTA IMPORTANTE: Corvelva te invita a profundizar en la información leyendo todos los apartados y enlaces, así como en los prospectos y fichas técnicas de los productos del fabricante, y a hablar con uno o varios profesionales de confianza antes de decidir vacunarte a ti o a tu hijo. Esta información es solo para fines informativos y no pretende ser un consejo médico.
El problema de las vacunas múltiples (haga clic para abrir)
El problema de las vacunas múltiples

Los calendarios vacunales vigentes, especialmente para la edad pediátrica, prevén la administración de múltiples antígenos y vacunas en una sola sesión, privilegiando la comodidad en detrimento de la seguridad. Para poder hacer un discurso específico sobre la seguridad de las vacunas, necesariamente debemos tener en cuenta la complejidad del fenómeno, aconsejando a todos los lectores que se informen adecuadamente sobre todos los aspectos de la vacunación, pros y contras.
El Dr. Russell Blaylock, profesor asistente clínico de neurocirugía en el Centro Médico de la Universidad de Mississippi, ha estudiado la "sinergia tóxica" durante años y pudo observar que cuando dos pesticidas débilmente tóxicos, donde ninguno es capaz de causar el síndrome de Parkinson en animales de experimentación, se combinan entre sí, pueden causar la enfermedad incluso rápidamente y compara este fenómeno con el de múltiples vacunas administradas simultáneamente: "Las vacunas, si son demasiado numerosas y demasiado seguidas, se comportan como una enfermedad crónica".(A). Otros Dos estudios han confirmado que la muerte súbita del lactante puede ocurrir después de la inoculación de múltiples vacunas en una sola administración.(antes de Cristo)
Un estudio publicado en Human and Experimental Toxicology mostró que los países que prescriben más vacunas en niños tienden a tener tasas de mortalidad infantil más altas.(D) Por ejemplo, en Estados Unidos, donde los niños reciben 26 vacunas, mueren más de 6 niños por cada 1000 nacidos vivos, mientras que en Suecia y Japón, donde se administran 12 vacunas pediátricas, se reportan 3 muertes por cada 1000 nacidos vivos. En el estudio antes mencionado, también se considera el vínculo entre las vacunas y los SMSL.
De un estudio suizo publicado en 2005 en el European Journal of Pediatrics(E) Obtenemos que, en cuanto a los efectos sobre los prematuros, la incidencia de apneas y bradicardias recurrentes o aumentadas tras la administración de vacunas hexavalentes es del 13%. Ese mismo año, la misma revista publicó un estudio alemán que había examinado las muertes infantiles repentinas después de hexavalente. Los autores escriben: «Estos resultados, basados en informes espontáneos, no prueban una relación causal entre la vacunación y la muerte súbita del lactante, pero constituyen una señal respecto a uno de los dos hexavalentes disponibles; señal que debe llevar a intensificar la vigilancia de las muertes súbitas de lactantes después de la vacunación".(F)
En 2006, se publicó en la revista médica Vaccine(G) la carta de un equipo de investigadores de la Universidad de Munich que informaba de «seis casos de muerte súbita infantil después de la vacunación hexavalente. Todos encontrados muertos sin explicación 1-2 días después de la vacunación». Habían sido clasificados como casos típicos de muerte súbita infantil pero la verificación autóptica había revelado anomalías neuropatológicas e histológicas y todos los niños presentaban un edema cerebral importante que los convertía en una excepción en comparación con los demás casos de SMSL (Síndrome de muerte súbita infantil). Los investigadores escribieron que “Antes de la introducción de la vacuna hexavalente (en los años 1994-2000), habíamos observado el caso de solo uno de cada 198 niños con muerte súbita del lactante que murió poco después de la vacunación con DTP. Pero entre 2001 y 2004 habían identificado cinco casos similares de 74 con SIDS. Eso indicaría un aumento de trece veces".
También en 2006 en Virchows Archive(H), escribió el equipo del Instituto de Patología de la Universidad de Milán: «Expertos de la Agencia Europea para la Evaluación de Productos Médicos han analizado la posibilidad de que pueda haber un vínculo entre las vacunas hexavalentes y algunos casos de muerte. Participaron patólogos con experiencia en vacunas y síndrome de muerte súbita del lactante que realizaron las autopsias, pero, hasta donde sabemos, se prestó poca atención al examen del tronco encefálico y del corazón sanguíneo en cortes seriados y no hubo posibilidad de establecer un papel desencadenante. de la vacuna para estas muertes. A continuación presentamos el caso de una niña de 3 meses que falleció súbitamente tras vacunación hexavalente. El examen del tronco encefálico en secciones seriadas reveló hipoplasia de núcleo arqueado bilateral. El sistema de conducción del corazón presentaba dispersión y degeneración fetal persistente. Este caso ofrece una comprensión única del posible papel de la vacuna hexavalente en desencadenar una consecuencia letal en un niño vulnerable. Cualquier caso de muerte súbita e inesperada que ocurra poco después del nacimiento o en la primera infancia, especialmente después de una vacunación, siempre debe someterse a una necropsia completa, de acuerdo con las pautas.
Referencias
- Blaylock R, "Vacunaciones: los peligros ocultos", The Blaylock Wellness Report, mayo de 2004, pp.1-9
- Ottaviani G. et al., "Síndrome de muerte súbita del lactante (SMSL) poco después de la vacunación hexavalente: ¿otra patología en la sospecha de SMSL?", Virchow Archivo, 2006, 448, págs. 100-104.
- Zinka B. et al., "Casos inexplicables de muerte súbita infantil poco después de la vacunación hexavalente", Vaccine, julio de 2006, 24 (31-32), págs. 5779-5780.
- Miller NZ et al1. , "Tasas de mortalidad infantil retrocedidas contra el número de dosis de vacuna administradas de forma rutinaria: ¿existe una toxicidad bioquímica o sinérgica??", Hum. Exp. Toxicol., mayo de 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
El problema del aluminio (haga clic para abrir)
Aluminio en las vacunas: lo que los padres deben saber

1. ¿Qué es el aluminio?
El aluminio es un metal ligero de color blanco plateado, maleable y resistente. Estas cualidades lo hacen útil en numerosas industrias y productos, incluyendo maquinaria, construcción, almacenes, utensilios de cocina, textiles, tintes y cosméticos. El aluminio es también el metal más abundante en la corteza terrestre, y prácticamente todo el aluminio del medio ambiente se encuentra en el suelo. Sin embargo, el aluminio no se encuentra naturalmente en cantidades significativas en los organismos vivos (como plantas y animales) y no tiene una función biológica conocida. Durante el siglo pasado, el uso de aluminio en algunos productos ha llevado a una mayor exposición humana. Las principales fuentes de exposición son los alimentos que contienen aluminio (p. ej., polvo de hornear, alimentos procesados, fórmulas para bebés, etc.), productos médicos (p. ej., antitranspirantes, antiácidos, etc.), inyecciones para alergias y vacunas.1 - 3
2. ¿Por qué está presente el aluminio en las vacunas?
Algunas vacunas utilizan compuestos de aluminio (hidróxido de aluminio y fosfato de aluminio) como adyuvantes, que son ingredientes que aumentan la respuesta inmunitaria a un antígeno (sustancia extraña).4 - 5 La Administración de Drogas y Alimentos de los Estados Unidos (FDA) dice que si algunas vacunas no incluyeran aluminio, la respuesta inmune que desencadenan podría disminuir.6
3. ¿Qué vacunas contienen aluminio?
Las siguientes vacunas contienen aluminio y se administran a lactantes, niños y adolescentes (fig. 1):
- Hepatitis B (HepB)
- hexavalente
- Difteria, tétanos y tos ferina (DTaP y Tdap)
- Haemophilus influenzae tipo b (PedvaxHIB)
- Neumococo (PCV)
- Hepatitis A (HepA)
- Virus del papiloma humano (VPH)
- Meningococo B (MenB)
Figura 1: Se administran hasta 18 dosis de vacunas que contienen aluminio desde el nacimiento hasta los 22 años7 - 8
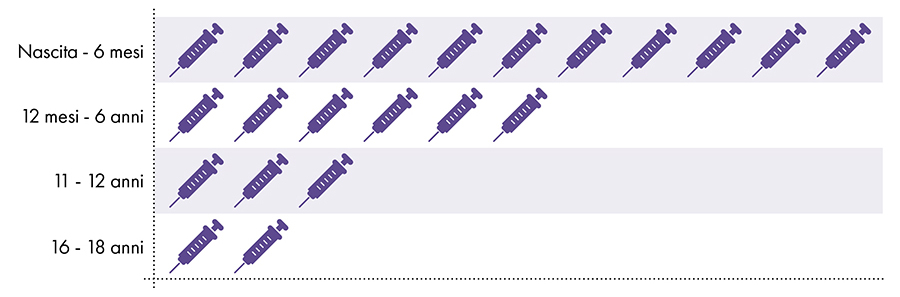
4. ¿Es segura la exposición al aluminio?
La FDA ha considerado el aluminio generalmente reconocido como seguro (GRAS) desde 1975.9 Sin embargo, antes de 1990, no había tecnología para detectar con precisión pequeñas cantidades de aluminio administradas a sujetos en estudios científicos.10 En consecuencia, se desconocía la cantidad de aluminio que podía absorberse antes de la aparición de los efectos adversos.
Desde la década de 1990, gracias a los avances tecnológicos, se ha observado que las pequeñas cantidades de aluminio que quedan en el cuerpo humano interfieren en una serie de procesos celulares y metabólicos en el sistema nervioso y tejidos de otras partes del cuerpo.1-10-11 Los mayores efectos negativos del aluminio se han observado en el sistema nervioso y van desde deterioro de las habilidades motoras hasta encefalopatía (estado mental alterado, cambios de personalidad, dificultades para pensar, pérdida de memoria, convulsiones, coma y más).2 - 12
El Departamento de Salud y Servicios Humanos de los Estados Unidos (HHS) reconoce al aluminio como una neurotoxina conocida.2 Además, la FDA ha advertido sobre los riesgos de toxicidad por aluminio en bebés y niños.13
REGISTRO FEDERAL: El diario del gobierno de los Estados Unidos"Incluso los bebés nacidos a término con una función renal normal pueden estar en riesgo debido al rápido crecimiento y la inmadurez del cerebro y el esqueleto, así como a la inmadurez de la barrera hematoencefálica. Hasta la edad de 1 o 2 años, los bebés tienen una menor tasa de filtración glomerular que los adultos, lo que afecta su función renal. La agencia teme que los niños pequeños y aquellos con función renal inmadura tengan un mayor riesgo de exposición al aluminio ". |
5. ¿Cuánto aluminio oral no es seguro?
En 2008, la Agencia para el Registro de Sustancias Tóxicas y Enfermedades (ATSDR), una división del HHS, utilizó estudios sobre los efectos neurotóxicos del aluminio para determinar que no más de 1 miligramo (1.000 microgramos) de aluminio por kilogramo de peso corporal por día para evitar los efectos negativos del aluminio.2
6. ¿Cuánto aluminio inyectado no es seguro?
Para determinar la cantidad de aluminio que se puede inyectar de manera segura, es necesario convertir el límite de aluminio oral de la ATSDR. El límite de la ATSDR para el aluminio oral (1.000 microgramos de aluminio por kilogramo de peso corporal por día) se basa en el 0,1 % del aluminio oral que se absorbe en el torrente sanguíneo, ya que el tracto digestivo bloquea casi todo el aluminio oral.2 Por el contrario, el aluminio inyectado por vía intramuscular no pasa por el tracto digestivo y el 100 % del aluminio se puede absorber en el torrente sanguíneo con el tiempo (es decir, la proporción de aluminio absorbido es 1.000 veces mayor). Para tener en cuenta estas diferentes cantidades de absorción, el límite de aluminio oral de la ATSDR debe dividirse por 1000. Esta conversión conduce a un límite de aluminio en sangre derivado de la ATSDR de 1 microgramo de aluminio (0,1 % de 1.000 microgramos) por kilogramo de peso corporal. por día. En consecuencia, para evitar los efectos neurotóxicos del aluminio, no debe ingresar al torrente sanguíneo más de 1 microgramo de aluminio por kilogramo de peso corporal diariamente. La Figura 3 muestra el límite de aluminio en sangre derivado de la ATSDR para bebés de varias edades según su peso.
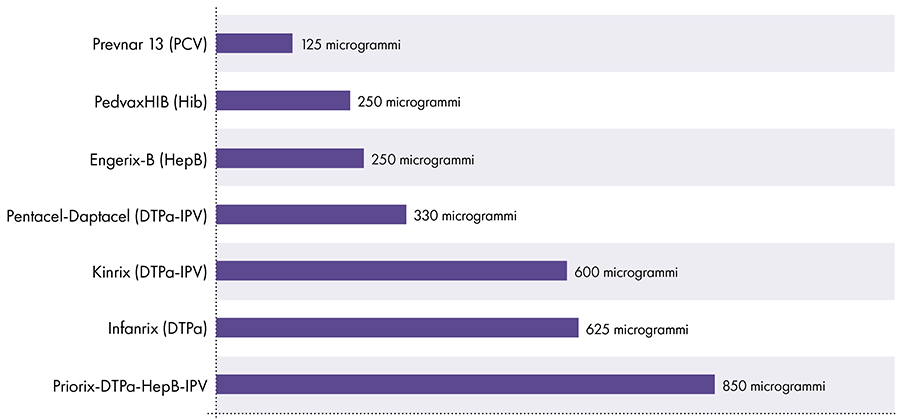
7. ¿Cuánto aluminio hay en las vacunas?
La cantidad de aluminio en las vacunas varía.16 En 1968, el gobierno federal de los EE. UU. fijó el límite para la cantidad de aluminio en las vacunas en 850 microgramos por dosis, según la cantidad de aluminio necesaria para que algunas vacunas sean efectivas.6 - 17 En consecuencia, la cantidad de aluminio en las vacunas infantiles que contienen aluminio oscila entre 125 y 850 microgramos por dosis. La Figura 4 muestra el contenido de aluminio de una dosis de varias vacunas administradas a niños.
8. ¿Algún estudio ha comparado la cantidad de aluminio en las vacunas con el límite derivado de la Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR)?
En 2011 se publicó un estudio que tenía como objetivo comparar la cantidad de aluminio en las vacunas con el límite de flujo sanguíneo establecido por la ATSDR.18 Sin embargo, este estudio basó incorrectamente sus cálculos en el 0,78 % de aluminio oral absorbido en el torrente sanguíneo, en lugar del valor del 0,1 % utilizado por la ATSDR en sus cálculos.19 - 20 Como resultado, el estudio de 2011 planteó la hipótesis de que casi 8 veces (0,78 %/0,1 %) el aluminio puede entrar de forma segura en el torrente sanguíneo, y esto ha llevado a una conclusión incorrecta.
9. ¿Es segura la exposición al aluminio de las vacunas?
Las vacunas se inyectan por vía intramuscular y se desconoce la velocidad a la que el aluminio de las vacunas migra del músculo humano al torrente sanguíneo. Los estudios en animales sugieren que el aluminio de las vacunas puede tardar desde un par de meses hasta más de un año en ingresar al torrente sanguíneo, debido a múltiples variables.21 - 23 Dado que la exposición acumulada al aluminio de las vacunas en niños menores de un año supera el límite diario establecido por la ATSDR en varios cientos (Fig. 3 y 4), el límite aún se superaría si el aluminio de las vacunas entrara en el flujo sanguíneo durante el curso. de aproximadamente un año. Además, los estudios han demostrado que el aluminio de las vacunas es absorbido por las células inmunitarias y llega a partes del cuerpo alejadas del lugar de la inyección, incluido el cerebro.24
Se desconoce el alcance de los efectos adversos del aluminio en las vacunas, ya que no se han realizado estudios de seguridad que comparen una población vacunada con vacunas que contienen aluminio con una población no vacunada con dichas vacunas.
Limitación del flujo sanguíneo por aluminio derivada de la ATSDR2-14-15
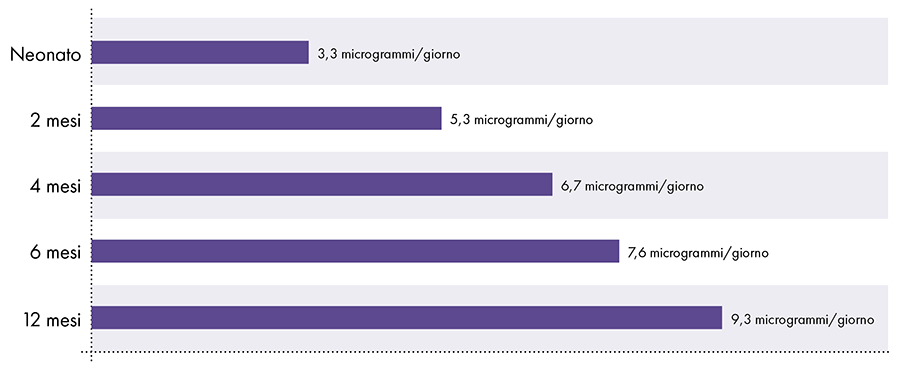 Figura 3: Este gráfico muestra el límite de aluminio para niños de varias edades, según se deriva del Registro de Sustancias Tóxicas y Enfermedades, una división del Departamento de Salud y Servicios Humanos de los Estados Unidos. El límite indica que no debe ingresar al torrente sanguíneo más de 1 microgramo de aluminio por kilogramo de peso corporal diariamente para evitar los efectos neurotóxicos del aluminio.
Figura 3: Este gráfico muestra el límite de aluminio para niños de varias edades, según se deriva del Registro de Sustancias Tóxicas y Enfermedades, una división del Departamento de Salud y Servicios Humanos de los Estados Unidos. El límite indica que no debe ingresar al torrente sanguíneo más de 1 microgramo de aluminio por kilogramo de peso corporal diariamente para evitar los efectos neurotóxicos del aluminio.
Cantidad de aluminio en las vacunas
Referencias
- Academia Estadounidense de Pediatría, Comité de Nutrición. Toxicidad por aluminio en lactantes y niños. Pediatría. 1996 marzo, 97 (3): 413.
- Agencia para Sustancias Tóxicas y Registro de Enfermedades (ATSDR). Perfil toxicológico del aluminio. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU.; 2008.3, 13-24, 145, 171-7, 208.
- Yokel RA. Aluminio en los alimentos: naturaleza y contribución de los aditivos alimentarios. En: El-Samragy Y, editor. Aditivo alimentario. Rijeka (Croacia): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. Hacia una comprensión de la acción adyuvante del aluminio. Nat Rev Inmunol. abril de 2009, 9 (4): 287.
- Volk VK, Bunney WE. Inmunización diftérica con toxoide líquido y toxoide precipitado con alumbre. Am J Salud Pública Naciones Salud. julio de 1942, 32 (7): 690-9.
- Baylor NW, Egan W, Richman P. Sales de aluminio en vacunas: perspectiva estadounidense. Vacuna. 2002 de mayo de 31, 20 Suplemento 3: S18-22.
- Administración de Drogas y Alimentos de los Estados Unidos. Silver Spring (MD): Administración de Drogas y Alimentos de los Estados Unidos. Vacunas autorizadas para su uso en los Estados Unidos; [actualizado el 2018 de febrero de 14; citado el 2018 de febrero de 27]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Centros de Control y Prevención de Enfermedades. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Calendario de vacunación recomendado para niños y adolescentes de 18 años o menos, Estados Unidos, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- Administración de Drogas y Alimentos de los Estados Unidos. Silver Spring (MD): Administración de Drogas y Alimentos de los Estados Unidos. SCOGS (Comité Selecto sobre Sustancias GRAS); [citado el 2018 de agosto de 16]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Sacerdote ND. El comportamiento biológico y la biodisponibilidad del aluminio en el hombre, con especial referencia a los estudios que emplean aluminio-26 como marcador: revisión y actualización del estudio. J Environ Monit. 2004; 6: 376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. Aluminio en productos de nutrición parenteral pediátrica: contenido medido versus etiquetado. J Pediatr Pharmacol Ther. 2011, 16 (2): 92-7.
- Sedman A. Toxicidad por aluminio en la infancia. Pediatr Nephrol. 1992 julio, 6 (4): 383-93.
- Administración de Drogas y Alimentos de los Estados Unidos, Departamento de Salud y Servicios Humanos. Reglas y regulaciones. Registro Federal. junio de 2003, 68 (100): 34286.
- Centros de Control y Prevención de Enfermedades. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Centro Nacional de Estadísticas de Salud: tabla de datos para gráficos de longitud para la edad y peso para la edad de niños; [citado el 2019 de abril de 2]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Centros de Control y Prevención de Enfermedades. Washington, DC: Departamento de Salud y Servicios Humanos de EE. UU. Centro Nacional de Estadísticas de Salud: tabla de datos para tablas de longitud para la edad y peso para la edad de las niñas; [citado el 2019 de abril de 2]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- Administración de Drogas y Alimentos de los Estados Unidos, Departamento de Salud y Servicios Humanos. Revisión de los requisitos para los materiales constituyentes. Regla definitiva. Registro Federal. 2011 de abril de 13, 76 (71): 20513-8.
- Oficina del Registro Federal, Servicio Nacional de Archivos y Registros, Administración de Servicios Generales. Reglas y regulaciones. Registro Federal. 1968 enero; 33 (6): 369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Farmacocinética de aluminio actualizada después de la exposición infantil a través de la dieta y la vacunación. Vacuna. 2011 28 de noviembre, 29 (51): 9538-43.
- Miller S, Médicos por el Consentimiento Informado. Fe de erratas en 'Farmacocinética de aluminio actualizada después de la exposición infantil a través de la dieta y la vacunación'. En: Research Gate. Berlín (Alemania): ResearchGate GmbH; 2020 de marzo de 6 [citado el 2020 de marzo de 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Médicos para el Consentimiento Informado. Newport Beach (CA): Médicos para el consentimiento informado. Fe de erratas en 'Farmacocinética de aluminio actualizada después de la exposición infantil a través de la dieta y la vacunación'; [citado el 2020 de marzo de 6]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. Absorción in vivo de adyuvantes de vacunas que contienen aluminio usando 26Al. Vacuna 1997 agosto-septiembre, 15 (12-13): 1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Ensayo de aluminio y evaluación de la reacción local en varios puntos de tiempo después de la administración intramuscular de vacunas que contienen aluminio en el mono Cynomolgus. Vacuna. 2005 de febrero de 3, 23 (11): 1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanislawski B. Aluminio en plasma y tejidos después de la inyección intramuscular de vacunas humanas con adyuvante en ratas. Arco Toxicol. octubre de 2019, 93 (10): 2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. Análisis crítico de estudios de referencia sobre la toxicocinética de adyuvantes a base de aluminio. JInorg Biochem. abril de 2018; 181: 87-95.
Artículo traducido por Médicos para el consentimiento informado
Según los CDC de EE. UU., los problemas que pueden surgir después de la vacunación con la vacuna conjugada neumocócica 13-valente (PCV13), la vacuna polisacárida neumocócica 23-valente (PPSV23) y cualquier otra vacuna incluyen:(1-2)
- Reacciones alérgicas graves que ocurren de minutos a horas después de la vacunación.
- Dolor severo en el hombro que limita el movimiento del brazo inyectado.
- Desmayo o colapso después de la vacunación. Se le puede recomendar que se siente o se acueste durante unos 15 minutos después de la vacunación para evitar desmayos y lesiones que podrían resultar de una caída. Es importante que informe a su médico si experimenta zumbidos en los oídos, cambios en la visión o mareos después de la vacunación.
Efectos secundarios de la vacuna PCV13 (vacuna antineumocócica conjugada)
Las reacciones adversas tras la administración de PCV13 varían según la dosis de la serie y la edad del receptor. En los niños, las reacciones notificadas con mayor frecuencia fueron irritabilidad, somnolencia, pérdida de apetito, enrojecimiento, dolor o hinchazón en el lugar de la vacuna y fiebre de leve a moderada.
Se descubrió que los niños que recibieron PCV13 al mismo tiempo que la vacuna inactivada contra la gripe tenían un mayor riesgo de convulsiones febriles.
En adultos, se han notificado principalmente enrojecimiento, hinchazón y dolor en el lugar de la inyección, fatiga, fiebre, escalofríos, dolor de cabeza y dolores corporales.(3)
Reacciones adversas de Prevenar 13 (PCV13) notificadas en bebés y niños durante los estudios clínicos previos a la aprobación:(4) dolor en el lugar de la inyección, hinchazón, enrojecimiento, fiebre, disminución del apetito, aumento y disminución del sueño, irritabilidad, diarrea, vómitos, sarpullido, urticaria, reacción de hipersensibilidad que incluye broncoespasmo, hinchazón de la cara y dificultad para respirar, convulsiones, neumonía, gastroenteritis, bronquiolitis, muerte ( reportado como SIDS).
Reacciones adversas de Prevenar 13 (PCV13) notificadas en adultos durante los estudios clínicos previos a la aprobación:(5) dolor, hinchazón y enrojecimiento en el lugar de la inyección, restricción del movimiento del brazo, fiebre, vómitos, escalofríos, dolores musculares, fatiga, dolor de cabeza, disminución del apetito, sarpullido, dolor en las articulaciones, muerte (las muertes informadas en la aprobación previa incluyeron muertes por cáncer, peritonitis, infección pulmonar por el complejo Mycobacterium avium y shock séptico).
Reacciones adversas de Prevenar 13 (PCV13) notificadas después de la comercialización:(6) Cianosis, linfadenopatía en el lugar de la inyección, anafilaxia, shock, hipotonía, palidez, apnea, edema angioneurótico, eritema multiforme, prurito en el lugar de la inyección, urticaria y exantema.
Ensayos clínicos de preaprobación de la primera vacuna antineumocócica conjugada, Prevenar (PCV7)comparó la seguridad de Prevenar (PCV7) con una vacuna contra la meningitis C en fase de investigación, lo que socava gravemente la validez científica del ensayo.
En los estudios clínicos de preautorización de Prevenar (PCV7), los niños de los grupos que recibieron la vacuna antineumocócica sufrieron más convulsiones, irritabilidad, fiebre alta y otras reacciones. Hubo 7 muertes en el grupo de Prevenar (PCV12), incluidas 5 muertes por el síndrome de muerte súbita del lactante (SMSL). No se han completado estudios a largo plazo para evaluar si la vacuna Prevenar (PCV7), administrada sola o en combinación con otras vacunas, tiene una asociación con enfermedades crónicas o discapacidades, como el desarrollo de diabetes, asma, trastornos convulsivos, dificultad de aprendizaje , TDAH.(7)
Los ensayos de seguridad previos a la aprobación de Prevenar 13 (PCV13) compararon esta vacuna de próxima generación con la vacuna Prevenar original (PCV7), una vacuna cuya seguridad no se estudió de forma adecuada, y en 2012 se informaron preocupaciones sobre un vínculo entre las convulsiones febriles y Prevenar 13 (PCV13). ).(8-9)
PCV13 se asoció con un riesgo elevado de convulsiones febriles cuando se administró de forma independiente(10) y cuando se administra en combinación con la vacuna contra la influenza inactivada por vía parenteral (IIV).(11)
Algunos estudios también han relacionado la vacuna PCV con el síndrome de Guillain-Barré,(12) a la poliserositis,(13) al hombro séptico(14) y eritema multiforme.(15)
Efectos secundarios de la vacuna PPSV23 (Pneumococcus polysaccharide)
Según los CDC, alrededor del 50 por ciento de las personas que reciben la vacuna antineumocócica polisacárida (PPSV23) experimentan dolor y enrojecimiento en el lugar de la inyección. Dolores corporales, fiebre y reacciones locales más severas también pueden ocurrir después de la administración de PPSV23.(16)
Reacciones adversas de PNEUMOVAX23 (PPSV23) notificadas en adultos durante los ensayos clínicos previos a la aprobación en EE. UU.:(17) dolor en el lugar de la inyección, enrojecimiento, picazón, moretones e hinchazón, dolor de cabeza, escalofríos, fiebre, diarrea, dispepsia, náuseas, infección del tracto respiratorio superior, dolor de espalda, dolor de cuello, faringitis, dolor muscular, fatiga, depresión, colitis, úlcera, dolor de pecho, angina de pecho, insuficiencia cardíaca, temblor, escalofríos, sudoración, accidente cerebrovascular, radiculopatía lumbar, pancreatitis, infarto de miocardio, muerte.
Casi el 80 % de los sujetos que participaron en los estudios clínicos previos a la aprobación experimentaron una reacción adversa en el lugar de la inyección después de la revacunación de tres a cinco años después de la vacuna inicial. La tasa de reacciones adversas sistémicas (dolor de cabeza, fatiga, mialgia) después de la revacunación con PPSV23 también fue mayor, con un 33 % de adultos de 65 años o más y un 37,5 % de adultos de 50 años o más entre 64 y XNUMX años que notificaron una reacción adversa.(18)
Reacciones adversas de PNEUMOVAX23 (PPSV23) informadas después de la comercialización:(19) Reacciones anafilactoides, enfermedad del suero, edema angioneurótico, artritis, artralgia, vómitos, náuseas, disminución de la movilidad de las extremidades, edema periférico en la extremidad inyectada, fiebre, malestar general, celulitis, calor en el lugar de la inyección, linfadenopatía, linfadenitis, leucocitosis, trombocitopenia en pacientes con enfermedad idiopática estable. púrpura trombocitopénica, anemia hemolítica en pacientes que han tenido otros trastornos hematológicos, parestesia, síndrome de Guillain-Barré, radiculoneuropatía, convulsiones febriles, exantema, eritema multiforme, urticaria, reacciones de tipo celulitis.
Aunque PNEUMOVAX23 (PPSV23) está aprobado para su uso en niños de dos años de edad y mayores con afecciones tales como enfermedades cardíacas y pulmonares crónicas, diabetes, implantes cocleares, fugas de LCR, enfermedad de células falciformes, asplenia funcional o anatómica e inmunosupresión, no hay información sobre la seguridad o eficacia de la vacuna en niños está disponible en el prospecto de la vacuna.(20)
Algunos estudios han relacionado la PPSV23 con reacciones inflamatorias sistémicas(21) y fiebre(22-23-24-25-26)
Referencias (haga clic para abrir)
- CDC Conjugado neumocócico (PCV13) VIS. 5 de noviembre de 2015
- CDC Polisacárido neumocócico VIS. Abril 24, 2015
- CDC Conjugado neumocócico (PCV13) VIS. 5 de noviembre de 2015
- FDA Prospecto de Prevnar 13 Agosto 22, 2017
- Ibid
- Ibid
- FDA Vacuna antineumocócica 7-valente conjugada (PREVNAR): prospecto del fabricante del producto. 1 de octubre de 2002
- Hit, E. Prevnar 13 debe vigilarse por riesgo de convulsiones febriles, dice el panel de la FDA. Medscape. 31 de enero de 2012
- Tse A, Tseng HF, Greene SK y col. Identificación de señales y evaluación del riesgo de convulsiones febriles en niños después de la vacuna trivalente inactivada contra la influenza en el Proyecto de enlace de datos de seguridad de vacunas, 2010-2011. Vacune. 2012 2 de marzo; 30 (11): 2024-31
- Baker M, Jankosky C, Yih K, et al. El riesgo de convulsiones febriles después de la influenza y las vacunas conjugadas neumocócicas 13-Valent. Foro abierto Infect Dis. Otoño de 2017; 4 (suplemento 1): S464–S465.
- CDC Vacunas infantiles y convulsiones febriles Jun. 20, 2016
- Ravishankar, N. Síndrome de Guillain-Barre después de la vacuna PCV. J Neurol Neurocirugía 4 (1): 134
- Tawfik P, Elie Gertner E, McEvoy CE Poliserositis severa inducida por la vacuna antineumocócica conjugada 13 valente: reporte de un caso J Med caso Rep. 2017; 11: 142.
- DeRogatis MJ, Parameswaran L, Lee P, et al. Articulación del hombro séptica después de la vacunación antineumocócica que requiere desbridamiento quirúrgico. HSS J. 2018 Oct;14(3):299-301
- Monastirli A, Pasmatzi E, Badavanis G et al. Eritema multiforme después de la vacunación antineumocócica. Acta Dermatovenerol Alp Pannonica Adriat. 2017 Mar;26(1):25-26.
- CDC Polisacárido neumocócico VIS. Abril 24, 2015
- FDA Pneumovax 23 - Vacuna Antineumocócica, Polivalente. Insertar paquete 30 de diciembre de 2014
- Ibid
- Ibid
- Ibid
- von Elten, KA, Duran LL, Banks TA, et al. Reacción inflamatoria sistémica después de la vacuna antineumocócica Serie de casos Hum Vacuna Inmunotro. 2014 de junio de 1; 10 (6): 1767–1770.
- Huang DT, Chiu NC, Chi H, et al. Fiebre prolongada con reacción similar a la celulitis en niños vacunados con polisacáridos neumocócicos. Pediatr Infect Dis J. 2008 Oct;27(10):937-9.
- Yousef E, Mannan S. Reacción sistémica a la vacuna antineumocócica: ¿qué tan común en pediatría? Alergia Asma Proc. 2008 Jul-Aug;29(4):397-9
- Gabor EP, Seeman M. Reacción sistémica febril aguda a la vacuna antineumocócica polivalente. JAMA. 1979 Nov 16;242(20):2208-9.
- Hasan S, Yousef M, Shridharani S Reacción sistémica febril grave a la vacuna antineumocócica. J Natl Med Assoc. 2005 Feb; 97 (2): 284–285.
- Lee A, Goyal R, Shan HY. Fiebre severa prolongada después de la vacuna antineumocócica. Soy J Med Sci. 2006 Dec;332(6):351-3.
Este artículo está resumido y traducido por Vacuna contra el Centro Nacional de Información.

