Primera publicación revisada por pares sobre vacunas MMRV (Priorix Tetra)

Finalmente, aquí estamos, después de casi dos años, se publica la primera publicación revisada por pares de nuestros análisis y se publicarán muchos otros.
El objetivo de este artículo es resumir los siguientes temas: qué se ha publicado, cuál es su validez y por qué es importante para nuestra investigación sobre vacunas. Todos estos argumentos serán tratados de manera coloquial y no técnica en las primeras páginas, mientras que a partir de la página 3, se realizará un estudio técnico para permitir que los especialistas de este sector evalúen el artículo en sí.
El artículo publicado en "F1000 Research"1 es el resultado del estudio inicial realizado por uno de los laboratorios que la Asociación Corvelva designó para llevar a cabo los análisis. Le recordamos, porque han pasado más de dos años desde el comienzo de este trabajo y se han agregado muchos otros resultados a los primeros, que El primer problema importante que tuvimos que investigar fue la cantidad anormal de ADN humano encontrado dentro de las vacunas analizadas.
Los análisis iniciales mostraron que tanto las vacunas cuadrivalentes de MMRV analizadas contenían de 1 a 2.7 microgramos / vial (como se publica en el presente artículo) y decidimos informar pública e inmediatamente dichos resultados porque, simplemente, no se esperaba que tal cantidad de El ADN podría estar presente dentro de una vacuna.
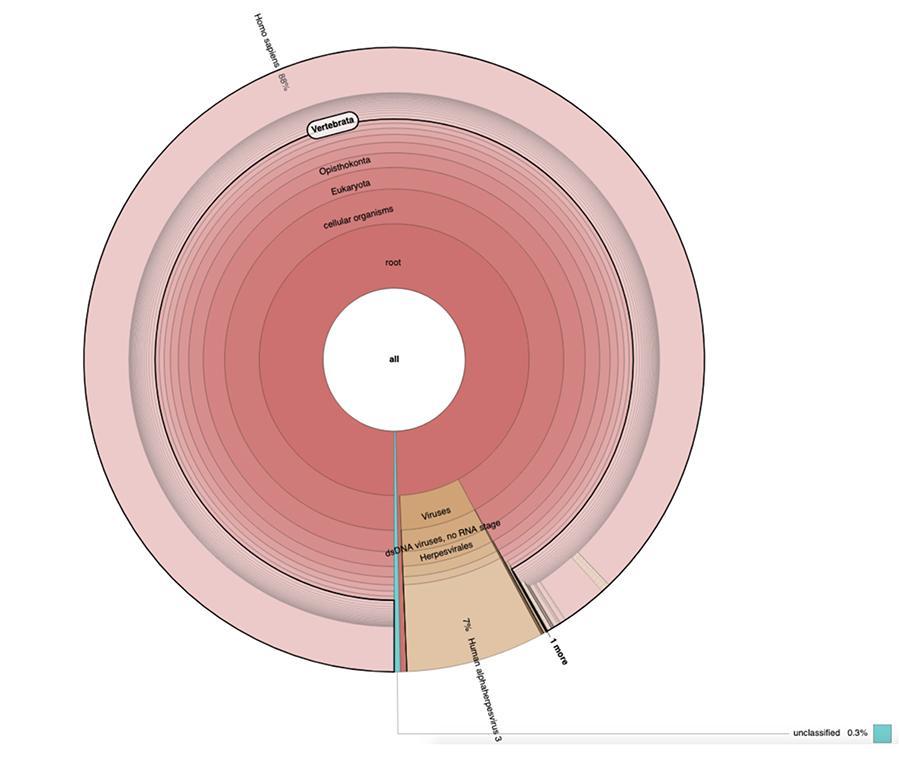
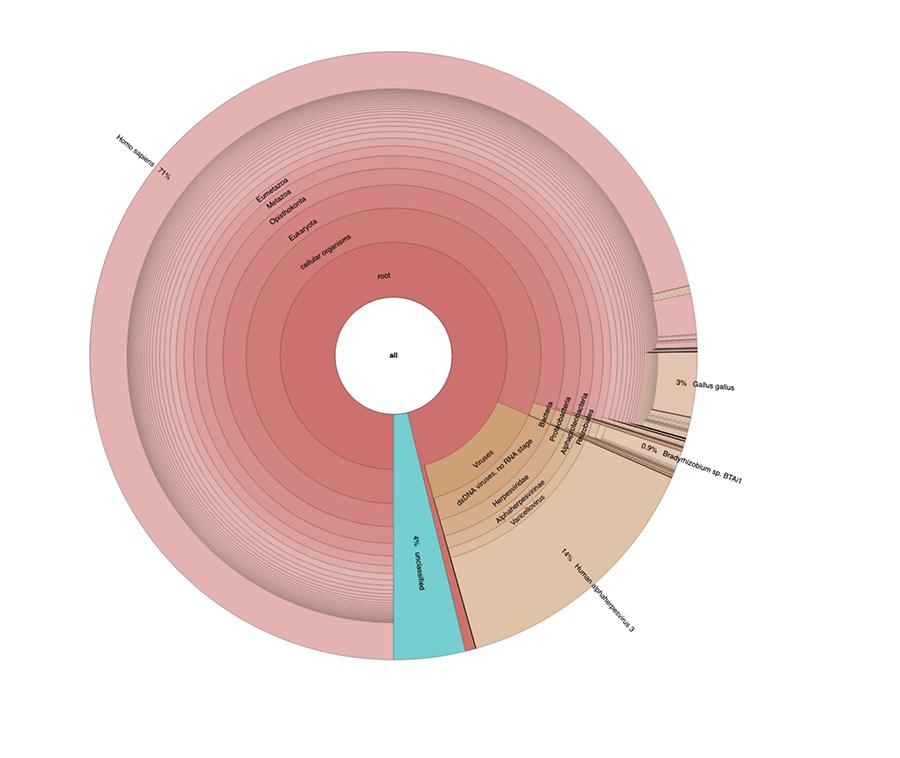
Además de las consideraciones y conclusiones alcanzadas por el estudio, que son estrictamente técnicas y, por lo tanto, comprensibles solo para aquellos que trabajan en el campo de la investigación metagenómica, lo que se observa en los gráficos es que las dos muestras de vacuna contienen un alto porcentaje de lecturas de ADN humano Además de los esperados del genoma del virus de la varicela (virus alfaherpes humano 3), el único detectable entre cuatro, como un tipo de análisis de ADN-seq, se presentó en el artículo.
Sin embargo, nos gustaría señalar que las cantidades de ADN que fueron encontradas y confirmadas por el mismo método que ahora está validado aquí fueron aún más altos: hasta 3.7 microgramos por vial, lo que lleva a una diferencia considerable de un lote a otro. De hecho, en nuestro informe publicado el 22 de diciembre de 20182 Se informaron los resultados obtenidos del análisis de diferentes lotes de los discutidos en el presente artículo, y luego se confirmaron mediante análisis interlaboratorio que aún están en proceso de publicación.
Por lo tanto, lo que debe considerarse de mayor interés en la presente publicación es que valida el método que utilizamos, da un punto importante a las discusiones sobre el "tipo" de análisis llevado a cabo, y como consecuencia confirma de manera definitiva todos los estudios que se han llevado a cabo posteriormente con el método NGS: el análisis en profundidad sobre el tipo de material genético, la presencia de virus adventicios, la gran ausencia de virus atenuados que deberían estar presentes y la cantidad de ADN humano que estaba completamente fuera de control (también porque es muy diferente de una muestra a otra) , la población mutante, los fagos, el ADN de otras especies, etc. Usted puede encontrar aTodos los resultados resumidos en nuestro sitio web3.
Todo lo que hemos denunciado en los últimos años, desde un punto de vista biológico, al informar exhaustivamente los resultados a los organismos de control, adquiere una connotación científica más relevante (incluso si, lo repetimos nuevamente, no fueron las revisiones por pares las que tuvieron que preocupación pero los datos presentados, muy serios en su contenido y sus posibles implicaciones para la salud humana). Sin embargo, ahora que se ha realizado la publicación del método, exigiremos las respuestas que aún no se nos han dado.
Indudablemente, estos resultados confirman la presencia de ADN fetal en las vacunas tetra Priorix, en cantidades variables de un lote a otro, lo que indica un control deficiente de la calidad de estos productos farmacéuticos.
También nos gustaría recordar el informe sobre la secuenciación completa del genoma MRC-5 publicado en el sitio web de Corvelva el 27 de septiembre de 20194 mostrando la profunda modificación de este ADN incluso en genes ligados al desarrollo de enfermedades tumorales (estos datos también serán publicados próximamente). El ADN fetal contaminante encontrado en todas las muestras analizadas en cantidades variables (es decir, no controladas) es hasta 300 veces mayor que el límite impuesto por la EMA para el ADN cancerígeno (10 ng / dosis, correspondiente al ADN contenido en aproximadamente 1000 células cancerosas, sobre la base de un cálculo estadístico, mientras que el límite de precaución es de 100 pg / dosis), límite que necesariamente debe aplicarse también al ADN fetal que contamina inevitablemente la vacuna Priorix Tetra.
Como consecuencia, esta vacuna debe considerarse defectuosa y potencialmente peligrosa para la salud humana, en particular para la población pediátrica, que es mucho más vulnerable al daño genético y autoinmune debido a la inmadurez de los sistemas de inmunidad.
Como se anticipó, la siguiente parte del artículo es más "técnica" y difícil de entender para los no expertos, por lo tanto, decidimos, incluso con fines de transparencia, adjuntar a este documento también "EMA Dossier - NGS Dossier Discusión sobre los resultados de la encuesta de calidad de la vacuna". Tuvimos que extrapolar solo la parte que podría publicarse, es decir, 50 páginas del expediente en comparación con las 200 páginas del NGS, ya que gran parte de la información contenida y registrada ante los organismos reguladores debe permanecer confidencial. La estricta ley de la ciencia dicta que una información se puede publicar en una revista solo si es original y, dado que tenemos otro trabajo en progreso, no queremos ponerla en riesgo.
EMA - NGS Dossier Discusión sobre los resultados de la encuesta de calidad de la vacuna ". - https://bit.ly/342XKi7
Finalmente, para evitar malentendidos, nos gustaría destacar la parte de la "Declaración de Financiamiento" de la publicación mencionada anteriormente:
"La secuencia metagenómica B1 y B2 fue financiada por Corvelva (asociación sin fines de lucro, Véneto, Italia), bajo un contrato de servicio con el laboratorio. Ninguna otra contribución estuvo involucrada en apoyar el trabajo. Los financiadores no tuvieron ningún papel en el diseño del estudio, la recopilación y análisis de datos, la decisión de publicar o la preparación del manuscrito "
Se adjunta:
- Publicación - ¿Me cuidas? Efecto de la reducción de cobertura en los estudios de secuenciación de escopeta metagenómica
- CORVELVA hilos NGS-EMA-eng
- Primera publicación revisada por pares sobre vacunas MMRV (Priorix Tetra)
En el artículo "¿Me covinas? Efecto de la reducción de la cobertura en los estudios de secuenciación de escopetas metagenoma "
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
Los autores abordan la cuestión técnico-metodológica de si es posible utilizar un enfoque metagenómico masivamente paralelo con baja cobertura de lectura para caracterizar matrices biológicas complejas. Estimaciones de diversidad, abundancia de especies y la capacidad de reconstruir el metagenoma. novo en términos de longitud e integridad se calculan, con el fin de comprender en qué medida la disminución en la profundidad de secuenciación, variada por lecturas de secuenciación de submuestreo aleatorio, puede afectar los resultados finales. Los resultados muestran que los índices de diversidad de las comunidades procariotas, eucariotas y virales complejas pueden estimarse con precisión con 500,000 lecturas o menos, aunque las muestras particularmente complejas pueden requerir 1,000,000 de lecturas. Por el contrario, un proyecto que involucra la reconstrucción del metagenoma y los genes contiene requiere más de 1,000,000 de lecturas.
Entre las diversas matrices complejas, y muy diferentes entre sí, sometidas a un análisis metagenómico masivo, se incluyeron dos medicamentos biológicos, a saber, dos lotes diferentes de vacuna de MPRV atenuada viva utilizada para la inmunización contra sarampión, paperas, rubéola y varicela en niños. Se extrajo el ADN de las vacunas, se construyeron bibliotecas genómicas utilizando protocolos comerciales estándar y se realizó una secuenciación masiva con la tecnología Illumina.
Además de las consideraciones y conclusiones alcanzadas por el trabajo, que son estrictamente técnicas y, por lo tanto, comprensibles solo para aquellos que realizan investigaciones en el campo de la metagenómica, lo que se observa en los gráficos circulares contenidos en los 'Datos extendidos'https://osf.io/wq395/ muestras B1 y B2) es que se encontró que las dos muestras de vacuna contenían un alto porcentaje de lecturas de ADN humano además de las esperadas del genoma del virus de la varicela (Human alfaherpes virus 3), el único detectable entre los cuatro, dado que se presentó un análisis de tipo DNA-seq en el artículo.
El 71% de las lecturas en un lote y el 88% en el otro son de origen humano, presumiblemente derivadas de la línea celular fetal MRC-5 (recuerde que el análisis posterior confirmó que la línea es MRC5) en la que se encuentran virus vivos de la rubéola y la varicela crecido durante la preparación de la vacuna. Además, como sucedió en los diferentes lotes de la misma vacuna MPRV probada por Corvelva entre 2017 y 2019, la cantidad de ADN extraído es del orden de microgramos.
En lotes de vacunas probados con los mismos protocolos y tecnología reportados en los materiales y métodos del artículo, las cantidades detectadas variaron de 1 a casi 3 microgramos por vial, cantidades que varían entre lotes, pero siempre significativas.
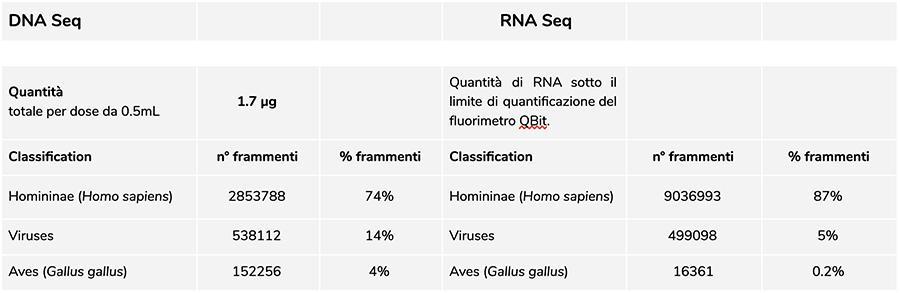
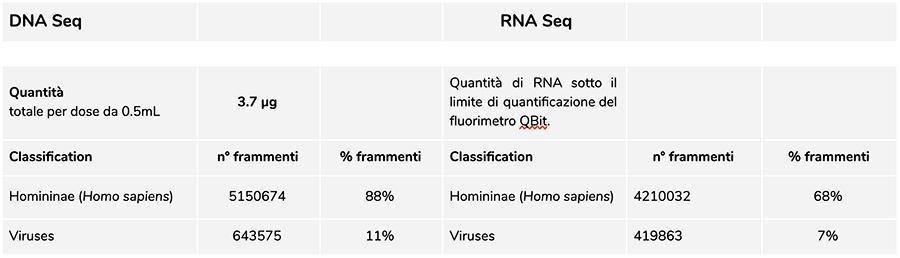
En el informe publicado por Corvelva el 22.12.2018 5, se informaron los siguientes resultados para lotes adicionales analizados después de los discutidos en el artículo, luego confirmados por análisis interlaboratorio aún en proceso de publicación.
Priorix Tetra lot. A71CB205A (junio de 2018) - Análisis de ADN
Priorix Tetra lot. A71CB256A (diciembre de 2018) - Análisis de ADN
Análisis de ADN
La medición de la concentración de ADN con fluorómetro QuBit mostró que el lote A71CB205A contiene un total de 1.7 µg de ADNg por dosis de 0.5 ml, calculado de la siguiente manera: 9.41 ng / µl (concentración determinada en QuBit) x 45 (volumen de resuspensión final de ADN después de la extracción, expresado en microlitros) x 4 (el volumen inicial sometido al procedimiento de extracción es ¼ del volumen de dosis contenido en el vial completo de 0.5 ml).
La medida de ADN concentración con fluorómetro QuBit mostró que el A71CB256A mucho contiene un total ADNg de 3.7 µg por dosis de 0.5 ml, calculado de la siguiente manera: 40.8 ng / µl (concentración determinada en QuBit) x 55 (volumen de resuspensión final de ADN después de la extracción expresada en microlitros) x 5/3 (el volumen inicial sometido al procedimiento de extracción es 300 µl en 500 µl de suspensión ).
El ADN humano que se encuentra en este lote es de aproximadamente 8 a 1 en relación con el ADN de la varicela (consulte los siguientes resultados de la clasificación de los fragmentos de ADN-seq, que muestran que el 88% del total de los fragmentos de ADN secuenciados son de origen humano, y el 11% son del genoma del virus de la varicela).
Teniendo en cuenta que NGS es una tecnología cuantitativa, la cuantificación fluorimétrica del ADN total extraído de la vacuna (por ejemplo, lote A71CB256A = 3.7 microgramos por dosis), combinada con la consideración de la cuantificación relativa realizada anteriormente (8: 1), nos permite decir que los humanos El ADN podría ser de aproximadamente 2.9 microgramos por dosis, en comparación con aproximadamente 740 nanogramos de ADN de varicela. También es plausible que al menos una porción del ADN de alto peso molecular visto en gel podría ser ADN humano de alto peso molecular.
Análisis de ARN
La cantidad de moléculas de ARN incluido en el vial de la vacuna El lote A71CB256A resultó ser aproximadamente 200ng.
El RIN igual a 8 indica un excelente calidad ARN y un ARN eucariota intacto, dado que están presentes los picos 18S y 28S típicos del ARN eucariota.
Las respuestas a nuestras preguntas enviadas a las agencias reguladoras a lo largo del tiempo son extremadamente importantes. Actualmente, las agencias aún no han respondido las preguntas sobre los resultados de los análisis completos entregados a la EMA y AIFA.
Extracto de la respuesta dada por la EMA a nuestra pregunta con respecto a la seguridad de los residuos de MRC-5 en la vacuna tetra Priorix® (solicitud de referencia EMA ask-43967 3 de agosto de 2018) - "Según la información publicada, Priorix® Tetra contiene cepas virales producidas por separado en células embrionarias de pollo (paperas y sarampión) o en células diploides humanas MRC-5 (rubéola y varicela). Las líneas celulares utilizadas para Priorix® Tetra incluyen líneas celulares diploides humanas que no pueden dividirse continuamente. Tenga en cuenta que, de acuerdo con la Farmacopea Europea, las líneas celulares diploides MRC-5 no son tumorigénicas, como lo demuestran décadas de uso y control, y por lo tanto el límite máximo para el ADN de las células MRC-5 no se aplica "
Al día de hoy, no se han proporcionado pruebas (ni en términos de certificados de análisis sobre la calidad del producto, ni de literatura científica de referencia para la EMA) de estos controles que garanticen que sea apropiado no aplicar un límite máximo.
En la directriz de la FDA "Orientación para la industria: caracterización y calificación de sustratos celulares y otros materiales biológicos utilizados en la producción de vacunas virales para indicaciones de enfermedades infecciosas"6 se afirma que:
- una cepa de células diploides siempre debe permanecer diploide. Si estas características no son estables, es necesario demostrar que la inestabilidad no afecta negativamente la producción o la conformidad del producto.
- Para las cepas de células diploides humanas ampliamente utilizadas, como las células MRC-5 y WI-38, la medición del ADN residual puede no ser necesaria porque no consideramos que el ADN residual de estas células diploides humanas sea un problema de seguridad
- El ADN residual debe limitarse para las células continuas no tumorigénicas, como las células VERDADERAS con un bajo número de pasajes, menos de 10 ng / dosis para la inoculación parenteral según lo recomendado por la OMS
Y la directriz de la OMS "Anexo 3 - Recomendaciones para la evaluación de cultivos de células animales como sustratos para la fabricación de medicamentos biológicos y para la caracterización de bancos de células. Reemplazo del Anexo 1 de la serie de informes técnicos de la OMS, n. 878 "agrega: (...) se ha acumulado una experiencia considerable en la citogenética de WI-38 y MRC-5 desde la década de 1960 y para respaldar esta experiencia, se enumeran los siguientes artículos:
- Jacobs JP. Resultados actualizados sobre la cariología de las cepas celulares WI-38, MRC-5 y MRC-9. Desarrollos en la estandarización biológica, 1976, 37: 155-156.
- Jacobs JP. et al. Directrices para la aceptabilidad, gestión y pruebas de células diploides humanas propagadas en serie para la producción de vacunas de virus vivos para su uso en el hombre. Journal of Biological Standardization, 1981, 9: 331–342.
- Petricciani JC y col. Estándares de cariología para la línea celular diploide rhesus DBS-FRhL-2. Journal of Biological Standardization, 1976, 4: 43-49.
- Schollmayer y col. Análisis de alta resolución y condensación diferencial en cromosomas humanos con banda RBA. Human Genetics, 1981, 59: 187–193.
- Rønne M. Preparación de cromosomas y técnicas de bandas de alta resolución: una revisión. Journal of Dairy Science, 1989, 72: 1363–1377.
Se puede observar claramente que la literatura de referencia que mantiene que las células diploides utilizadas para la producción de vacunas son seguras desde el punto de vista de la estabilidad genética, es obsoleto. Ya hace 40 años, se encontraron las primeras anomalías genéticas, consideradas insignificantes para la seguridad de las vacunas, y según lo informado en la directriz de la OMS, desde entonces no se han realizado actualizaciones con las nuevas tecnologías de secuenciación, en particular en NGS, que además económico y rápido, con la consecuencia de que en las vacunas administradas Durante décadas, las agencias han permitido la presencia de ADN modificado genéticamente cada vez más y en cantidades incontroladas. Sobre este tema, vea el informe sobre la secuenciación de todo el genoma MRC-5 publicado en el sitio web de Corvelva el 27.09.2019 en el que la modificación profunda de este ADN también es evidente en los genes asociados con el desarrollo de patologías tumorales. (datos que se publican)
A continuación se presenta un extracto de la carta del Dr. T. Deisher, experto mundial en el uso de células madre con fines terapéuticos y terapia génica, que destaca la preocupación por los riesgos asociados con el uso de vacunas contaminadas con residuos de células fetales humanas. :
Dr. T. DEISHER (carta a los gobernadores - 8 de abril de 2019) - (...) inyectar a nuestros niños con contaminación de ADN fetal humano conlleva el riesgo de causar dos patologías consolidadas:
- mutagénesis insercional: el ADN fetal humano se incorpora al ADN del niño causando mutaciones. La terapia génica con recombinación de fragmentos pequeños homólogos ha demostrado que cantidades tan pequeñas como 1.9 ng / mL de fragmentos de ADN resultan en la inserción de células madre en el genoma en el 100% de los ratones inyectados. Los niveles de fragmentos de ADN fetal humano en nuestros niños después de la vacunación con las vacunas MMR, VARIVAX (varicela) o hepatitis A alcanzan niveles superiores a 1.9 ng / ml.
- enfermedad autoinmune: el ADN humano fetal estimula la reacción del sistema inmunitario para atacar el cuerpo del niño.
Nuestros resultados fortalecen en gran medida las observaciones experimentales del Dr. Deisher, sobre todo el hecho de que el ADN fetal contaminante presente en todas las muestras analizadas en cantidades variables (por lo tanto, no controlado) es hasta 300 veces más alto que el límite impuesto por la EMA para el ADN cancerígeno (10 ng / dosis, que corresponde al ADN contenido en aproximadamente 1000 células cancerosas, obtenido sobre la base de un cálculo estadístico, mientras que el límite de precaución es 100 pg / dosis) límite que necesariamente debe aplicarse también al ADN fetal que inevitablemente contamina el Priorix® Tetra.
Por lo tanto, esta vacuna debe considerarse defectuosa y potencialmente peligrosa para la salud humana, en particular en la población pediátrica, que es mucho más vulnerable al daño genético y autoinmune debido a la inmadurez en los sistemas de reparación.
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate.html
https://www.corvelva.it/speciale-corvelva/vaccinegate-en.html - https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.federalregister.gov/documents/2010/03/04/2010-4553/guidance-for-industry-characterization-and-qualification-of-cell-substrates-and-other-biological

