Poročilo, ki poudarja prikrivanje smrti dojenčkov po cepljenju

Dva zdravnika v New Delhiju sta razkrila poskus večnacionalnega proizvajalca zdravil, da bi po uvedbi cepiva prikril nenadne smrti pri novorojenčkih. Jacob Puliyel, pediater v bolnišnici Santo Stefano, in epidemiolog C. Sathyamala, sta poročala o svojem odkritju v strokovni reviji Indian Journal of Medical Ethics.
Zadevno cepivo "Infanrix hexa", ki združuje cepiva proti proti davici, tetanusu, oslovskemu kašlju, hepatitisu B, otroški polio in gripi tipa B, proizvaja GlaxoSmithKline (GSK) in je bilo v Evropo uvedeno oktobra 2000.
Puliyel in Sathyamala sta prikrivanje odkrila z analizo podatkov v občasnih posodobljenih poročilih o varnosti (PSUR) v zvezi s cepivom, ki jih mora proizvajalec GSK redno zagotavljati Evropski agenciji za zdravila (EMA).
Ta zaupna varnostna poročila o tem cepivu je Puliyel prejel od italijanskega raziskovalca, ki jih je pridobil od EMA po zakonu o svobodi informacij - italijanski različici pravice do informacij v Indiji.
Glede na analizo so zdravniki ugotovili, da je zadnje poročilo o varnosti cepiva "Infanrix hexa", ki ga je predložil GSK (2015) je odpovedala smrt o čemer je proizvajalec že poročal v svojem 16. poročilu (2012). Vendar ugotavljajo, da v poročilu ni jasno, kako so bile te smrti odpovedane.
Avtorja Puliyel in Sathyamala ugotavljata, da je deset let po objavi članka Centra za nadzor bolezni (CDC), ki preučuje razmerje med MMR in avtizmom, eden od avtorjev William Thompson priznal, da je s svojimi soavtorji izpustil informacije. statistično pomembno - to je, da so afroameriški moški, ki so prejeli cepivo MMR pred 36. mesecem, povečali tveganje za avtizem. Potem ko so Thompson in njegovi sodelavci našli dokaze o tem povečanem tveganju, so izbrisali podatke otrok brez gruzijskih rojstnih listov (in zato diskvalificirali nesorazmerno veliko število črnih otrok) in predstavili svoje podatke, češ da ni bilo povečano tveganje za avtizem. Ni jasno, ali so avtorji PSUR 19 izvedli podobno retroaktivno diskvalifikacijo otrok, ki so bili dokumentirani, da so umrli v PSUR 16.
"Če teh smrti ne bi odpravili, bi bila smrt po cepljenju bistveno večja, kot bi po naključju pričakovali. Proizvajalec bi moral na EMA priznati, da je njihovo cepivo vzrok za te presežne smrti."
Puliyel in Sathyamala trdita, da mora proizvajalec "razložiti na videz napačne številke, ki jih je predložil regulativnim organom.
Do zdaj je proizvajalec trdil, da so smrtne primere po cepivu "naključne" in da bi pri teh otrocih prišlo, tudi če cepljenja ne bi prejeli.
Vendar Puliyel in Sathyamala v komentarjih svojega časopisa poudarjata, da je njihova analiza pokazala, da se je 83% prijavljenih smrti zgodilo takoj po cepljenju v prvih 10 dneh, le 17% pa v naslednjih desetih dneh.
"Če bi šlo za naključno smrt, potem ne bi vsi zbrali takoj po cepljenju, ampak bi bili enakomerno razporejeni v obdobju 20 dni."
Puliyel in Sathyamala pišeta, da kakršen koli argument, ki trdi, da se nenadne smrti po cepljenju izravnajo z življenji, ki jih je rešilo cepivo, ni sprejemljiv, na enak način, kot da bi bilo nezakonito ubiti osebo, da bi z njenimi organi rešili še pet ljudi. .
"Skrivanje smrti po cepljenju lahko prepreči ali odloži oceno varnostnega profila cepiva in to lahko privede do nepotrebnih in etično upravičenih smrti.
Avtorja poudarjata, da je bilo zdravilo Hexavac - podobno cepivo, ki ga je izdelal Sanofi Pasteur in ga leta 2000 tudi predstavilo na trg, leta 2005 umaknjeno z evropskega trga. Ugotovljeno je bilo, da se je smrt otrok povečala v dveh dneh po cepljenju.
V indijskem kontekstu avtorji poudarjajo, da bi moral indijski generalni nadzornik za droge (DCGI) ponovno preučiti veljavno politiko samodejnega odobritve za vsa zdravila, ki imajo dovoljenje v ZDA in Evropi. "Ta zanesljivost, ki temelji na skrbni presoji agencije EMA, je lahko napačna in jo je treba pregledati."
"Pentavac", ki ga izdeluje indijski inštitut za serum in se trži v Indiji, je podoben zdaj opuščenim zdravilom Hexavac in Infanrix Hexa, o katerih poročata, le da je celocelično cepivo proti oslovskemu kašlju nadomeščeno z acelularnim cepivom in ima šesta komponenta, injicirajoče polio cepivo. "
Puliyel in Sathyamala glede na njune povratne informacije predlagata, da "je nujno, da se DCGI zaveda poročil o PSUR, ki jih je predložil agenciji EMA, in pomislekov, povezanih s tem komentarjem".
Firma
Indijski časopis za medicinsko etiko na spletu Prvič objavljeno 5. septembra 2017
Infanrix hexa in nenadna smrt: pregled posodobitev periodičnih poročil o varnosti, predloženih Evropski agenciji za zdravila
JACOB PULIYEL, C SATHYAMALA
Avtor: Jacob Puliyel (ustrezni avtor -
Citiram: Puliyel J, Sathyamala C. Infanrix hexa in nenadna smrt: pregled periodičnih posodobljenih poročil o varnosti, predloženih Evropski agenciji za zdravila. Indijska J Med etika. Objavljeno v spletu 5. septembra 2017. Popravljeno 9. septembra 2017 *. DOI: 10.20529 / IJME.2017.079
Urejevalnik rokopisov: Mala Ramanathan © Indijski vestnik medicinske etike 2017
Minimalizem
Takoj po uporabi zdravila Infanrix hexa (kombinirano proti davici, tetanusu, cepivo proti oslovskemu oslovskemu kašlju, inaktivirani poliomielitis, hepatitis B in Haemophilus influenzae tipa B) je bilo več spontanih poročil. Proizvajalec GlaxoSmithKline (GSK) Evropski agenciji za zdravila (EMA) predloži občasna zaupna poročila o varnosti (PSUR) o Infanrix Hexa. Zadnji je PSUR * 19. Vsak PSUR vsebuje analizo opazovanih / pričakovanih nenadnih smrti, ki kaže, da je število smrti, opaženih takoj po imunizaciji, manjše od slučajnega.
Ta komentar se osredotoča na tisti vidik PSUR, ki vpliva na politične odločitve. Analizirali smo podatke, podane v PSUR. Očitno je, da je smrt, ugotovljeno v PSUR 16, odpravil PSUR 19. Število smrtnih primerov, ugotovljenih takoj po cepljenju pri otrocih, starejših od enega leta, je bilo bistveno večje od pričakovanega po naključju, ko so bile ugotovljene smrti obnovljena in vključena v analizo.
Proizvajalec mora razložiti številke, ki so jih predložili regulativnim organom. Treba je pregledati postopke, ki jih izvaja EMA za oceno proizvajalčevih opozoril v PSUR. Indijski generalni nadzornik za zdravila skoraj samodejno sprejme zdravila in cepiva, ki jih je odobril EMA. Potrebno je pregledati zaupanje v skrbnost s strani EMA.
Predstavitev
23. oktobra 2000 je prišlo na trg dveh cepivalentnih cepiv, Infanrix hexa® (GlaxoSmithKline plc-GSK) in Hexavac® (Sanofi Pasteur MSD, SNC), ki združujeta davico, tetanus, acelularni oslovski kašelj, hepatitis B, la inaktivirani poliomielitis in hemofilus gripe tipa B je bil odobren v Evropski uniji. Po odobritvi je bilo takoj po dajanju teh šesterovalentnih cepiv več spontanih poročil o nepričakovani nenadni smrti. Leta 2005 je von Kries in sodelavci (1) izvedli podrobno analizo, v kateri so primerjali smrt, ugotovljeno takoj po cepljenju, s pričakovanimi žrtvami. Ugotovili so, da se je standardizirano razmerje umrljivosti (SMR) v dveh dneh po cepljenju proti Hexavcu znatno povečalo pri otrocih, cepljenih v drugem letu življenja.
Z Infanrixom Hexa to ni bilo. Na zahtevo imetnika dovoljenja za promet je bil Hexavac leta 2005 umaknjen, Infanrix Hexa pa se je še naprej tržil v Evropi (2). V skladu z evropskim pravom je Evropska agencija za zdravila (EMA) odgovorna za varovanje javnega zdravja z vrednotenjem zdravil, ki jih odobri kot regulativni organ. Proizvajalci so odgovorni za učinkovitost, kakovost in varnost svojih zdravil (3).
Italijansko sodišče Nicola Di Leo je javnosti dajalo na razpolago periodična zaupna poročila o varnosti (PSUR) 15 in 16a od leta 2009 do 2011 družbe GlaxoSmithKline (4). PSUR 19 (ki vključuje PSUR 17, 18 in 19 z dne 15. januarja 2015) je italijanski raziskovalec pridobil od EMA v skladu s členom 3 pravil EMA (EMA 110196/2006 z dne 30. novembra 2010) (5 ). Italijanski zdravnik je ta PSUR poslal prvemu avtorju (JP) in ga pozval, naj napiše poročilo, ki ga bo predstavilo Evropskemu parlamentu. Ta komentar temelji na vseh teh PSUR-jih. V okviru varnostnega vidika, ki ga je prej izpostavil von Kries (1), ta komentar proučuje nenadno smrt po uporabi cepiva Infanrix Hexa. Drugi vidiki, zajeti v PSUR, se ne preučujejo.
PSUR 15 - skupina mrtvih po cepljenju
Večina smrti, ki se zgodijo v postneonatalnem obdobju, je posledica okužb, napak pri rojstvu, malignih bolezni ali nesreč. Otroci redko umrejo brez očitnega vzroka, zato so smrti uvrščeni med (i) sindrom nenadne smrti (SIDS), ki je v PSUR opredeljen kot smrt, ki se pojavi v prvem letu življenja in ostane nepojasnjena po obdukciji, ali (ii ) nepričakovana nenadna smrt (JUŽNA), ki je opredeljena kot smrt, ki se zgodi v prvih dveh letih življenja in ostane nepojasnjena po klinični in končni zgodovini dogodkov, vendar brez obdukcije. Skupaj se ta dva štejeta za nenadno smrt (SD) v PSUR 15. Določeno število cepiv dobijo otroci, mlajši od 2 let, na določen dan, število cepljenih otrok po vsem svetu pa je zelo veliko. Možno je, da bi nekateri cepljeni otroci pomotoma umrli zaradi SIDS-a / JUGA, do takšnih dogodkov bi prišlo, tudi če tega dne ne bi bili cepljeni. Da bi ugotovili, ali je bila takšna smrt posledica cepljenja ali je bil nenamerni dogodek, se izvede opazovana / pričakovana analiza SD. Analiza ocenjuje, ali število smrti, ugotovljenih po cepljenju, presega tisto, kar je mogoče napovedati po naključju.
Nenadna smrt: opažena v smeri pričakovanj
PSUR 15 pojasnjuje, kako je bila izvedena ta analiza (4: str. 782): "Društvo je ocenilo, ali se lahko število nenadnih smrtnih primerov, prijavljenih v tej starostni skupini, ki presegajo številko ena, zgodi naključno. Od starostne porazdelitve pri katerih osebah je bilo cepljeno neznano, je družba domnevala, da je delež neželenih učinkov po starosti reprezentativen za dejansko starostno razporeditev ob cepljenju, zato lahko ocenimo, da je 90,6% vseh prejemnikov zdravila Infanrix Hexa je bila v prvem letu življenja, 9,4% pa v drugem letu življenja, zato je bilo ocenjeno število odmerkov (od lansiranja) na 54.927.729 oziroma 5,698,904. Ker je Nemčija glavna država, v kateri so razdeljeni odmerki zdravila Infanrix Hexa (samo v Nemčiji skoraj 30%), je bila domneva, da je bila incidenca nenadne smrti v Nemčiji reprezentativna za celotno populacijo prejemnikov zdravila Infanrix Hexa (Zvezni uradNemška statistika, Statistisches Bundesamt; stopnja pojavnosti v prvem letu življenja: 0,454 / 1000 živorojenih; drugo leto: 0.062 / 1000 živorojenih, podatki iz leta 2008).
"PSUR dokumentira prijavljeno smrt v 20 dneh po cepljenju. Število umrlih je bilo nižje od pričakovanega (tabela 1).
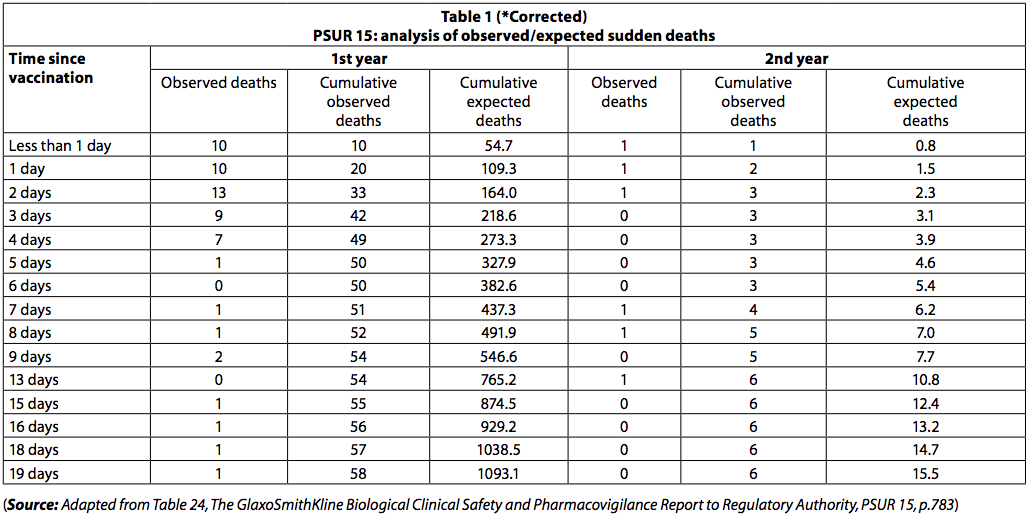
Vendar se je med novorojenčki umrlo takoj po cepljenju, pri čemer se je 42 smrtnih primerov zgodilo v prvih treh dneh po cepljenju in le 8 v naslednjih 3 dneh. Med mlajšimi od enega leta se je v prvih desetih dneh zgodilo 54 smrtnih primerov (93%), v naslednjih 4 dneh pa 7 (10%). Če bi bili smrtni primeri "naključni smrtni primeri zaradi SIDS-a", te razlike v številu smrtnih primerov v teh dveh obdobjih ne bi bilo opaziti.
Smrti zaradi SIDS-a bi bile enakomerno porazdeljene v obdobju 20 dni.
Dejstvo, da se smrtnost s časom imunizacije hitro znižuje, kaže na to, da je smrt lahko povezana s cepljenjem.
Podobno je bilo med otroki, starejšimi od enega leta, v prvih 5 dneh smrtnih primerov (83,3%), v naslednjih 10 dneh pa ena smrt (17%). Razvrščanje smrtnih primerov, poročanih v PSUR 10, je bilo zabeleženo tudi v PSUR 15 in to je bilo že prej komentirano (16).
Odgovor GlaxoSmithKline
V odgovor na to kritiko (7) je glavni izvršni direktor GlaxoSmithKline (GSK) Sir Andrew Witty prek dr. Normana Begga, glavnega zdravstvenega direktorja podjetja, v pismu predlagal, da obstaja veliko večja verjetnost omisliti morebitno vzročno zvezo in nato GSK prijaviti neželene dogodke, če se pojavijo kmalu po cepljenju in ne tednov kasneje. Nadalje je zapisal: "Glede na zgoraj navedeno ostajamo prepričani v sklepe, ki jih je predhodno sprejel GSK in jih z regulatornimi agencijami in zdravstvenimi organi po vsem svetu delili, da trenutno razpoložljivi podatki ne kažejo na povečano tveganje za nenadno smrt dojenčkov po cepljenje z zdravilom Infanrix hexa. Če se razpoložljivi podatki in informacije spremenijo in nakazujejo, da obstaja večje tveganje, ostajamo zavezani, da bomo nemudoma obvestili organe in sprejeli potrebne ukrepe za sporočanje takšnih podatkov in informacij zdravstvenim delavcem. "
Ta odgovor vsebuje tiho priznanje, da v obdobju po cepljenju ni bilo aktivne budnosti in so bile v rubriko "opažene smrti" vključene samo smrti, ki so bile spontano poročane GSK. To bi lahko povzročilo podcenjevanje smrti po cepljenju. Treba je opozoriti, da se število razdeljenih odmerkov cepiva uporablja za "pričakovano smrt". Poročilo potrjuje, da niso bili nujno uporabljeni vsi odmerki razdeljenega cepiva. Na ta način se je število "pričakovanih smrti" napihnilo.
Vendar pa glede na razlago in zagotovilo generalnega direktorja, da se je GSK zavezala, da bo nemudoma obvestila organe in zdravstvene delavce o vsakem povečanem tveganju z zdravilom Infanrix Hexa, vprašanja razvrščanja smrtnih primerov še niso raziskana.
PSUR 16: podvojitev pričakovanih smrti
Če vsi otroci, ki so prejeli prvi odmerek cepiva, prejmejo skupaj štiri odmerke in zadnji odmerek dodelijo v drugem letu življenja, potem je mogoče oceniti, da se četrtina (25%) odmerkov daje starejšim otrokom do enega leta. To je priporočeni načrt cepljenja v Nemčiji. Vendar nekatere države, kot je Italija, priporočajo le tri odmerke, vse v prvem letu in nobenem v drugem. Poleg tega vsi otroci ne dobijo vseh priporočenih odmerkov. Torej 20–25% odmerkov verjetno ne bomo uporabili v drugem letu. V PSUR 15 so ocenili, da je bilo 90,6% prodanih odmerkov uporabljenih pri dojenčkih, mlajših od enega leta, in 9,4% pri otrocih, starejših od enega leta. V PSUR 16 se je ocena odmerkov, prejetih v drugem letu, več kot podvojila (z 9,4% na 20%), zato se je ocena pričakovanih smrti podvojila. Kljub podvojitvi pričakovanih smrti je bilo število smrtnih primerov, opaženih v drugem letu, večje od pričakovanih v prvih 3 dneh po cepljenju (Tabela 36, str. 249). Če je ocena v PSUR 15, da se v drugem letu uporabi 9,4% odmerkov, pravilna, to velja tudi za PSUR 16 in je zato opažena smrt večja od pričakovane smrti v prvih 7 dneh.
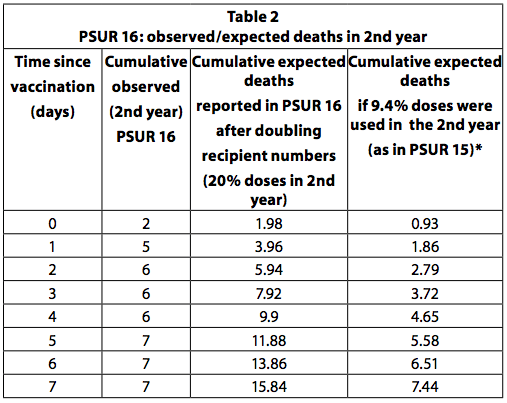
PSUR 19: napovedane smrti, tehtane glede na državo in letni delež odmerkov
V PSUR 19 je bilo izračunano koledarsko tehtano povprečje stopenj pojavnosti nenadnih smrti iz Nemčije, Francije in Nizozemske, da je prišlo do pričakovane incidence nenadne smrti.
Povedano zelo preprosto, to pomeni, da če je bilo v določenem letu v Nemčiji razdeljenih 60% odmerkov, je bila stopnja SD (nenadna smrt) v Nemčiji pri izračunu stopnje SD deležna 60-odstotno utež. na splošno za to leto; če je bilo 30% porazdeljeno v Franciji, je stopnja SD v Franciji prispevala 30%, teža 10% pa nizozemska stopnja SD. Končno je bila izračunana globalna stopnja SD za vsa leta skupaj.
Skupna stopnja SD je bila za drugo leto izračunana kot 0.0102 / 1000 živorojenih otrok. Ta številka je šestina pričakovane pogostosti, uporabljene v PSUR 15 in 16 (ki je izračunala nenadne smrti pri 0,062 / 1000 živorojenih otrok z uporabo nemških podatkov).
Poassonov interval zaupanja (CI) 95% smrti, opaženih v drugem letu, je prikazan v preglednici 8 ap 447 PSUR 19. Poroča se, da je bilo v drugem letu življenja število opaženih smrti večje, tudi če ne bistveno, kot pričakovana smrt v obdobju 1-4 dni po cepljenju.
Manjkajoče smrti v PSUR 19
S PSUR 16 na PSUR 19 so se skupni odmerki cepiva povečali s 69 na 112 milijonov. Glede na PSUR 19 se je domnevalo, da je bilo 20,2% razdeljenih odmerkov prejetih otrokom v drugem letu življenja (PSUR 19, str. 436-448). Izključeni so bili primeri smrti, pri katerih starost cepljenja ni bila znana, datum smrti ni bil zabeležen ali čas smrti presegel 19 dni od cepljenja.
PSUR 19 (smrti do 22. oktobra 2014) ne poroča o nenadnih smrti, omenjenih v PSUR 16 (primeri smrti, ki so se zgodili do 22. oktobra 2011). Treba je opozoriti, da sta bila v PSUR 16 zabeležena starost otroka, ki je umrl po cepljenju, in čas smrti (v 14 dneh po cepljenju).
Zabeleženi kumulativni smrtni primeri so manjši v PSUR 19 kot v PSUR 16. Kar zadeva otroke, starejše od enega leta, PSUR 19 beleži pojav le 5 smrti v prvih 19 dneh po cepljenju, medtem ko PSUR 16 poroča 8 Številke niso med seboj skladne. Sprašujemo se, zakaj je temu tako.
Deset let po objavi članka CDC (Center for Disease Control), ki preučuje razmerje med cepivom proti ošpicam, mumpsu in rdečkam (MMR) in avtizmu (8), je eden od avtorjev William Thompson priznal, da on in njegovi soavtorji niso pokazali statistično pomembnih informacij, da so afroameriški moški, ki so prejemali MMR pred 36. mesecem starosti, imeli večje tveganje za avtizem (9). Avtorji so izbrisali podatke o otrocih, ki v Gruziji niso imeli rojstnih listov (10), da bi izključili nesorazmerno število temnopoltih otrok, in predstavili svoje podatke, da bi pokazali, da ni prišlo do povečanja tveganje.
Ni jasno, ali so avtorji PSUR 19 podobno izključili mrtve in dokumentirane otroke v PSUR 16.
V tabeli 3 so prikazani opaženi in pričakovani smrtni primeri, poročani v PSUR 19, in smrti, ugotovljene po obnovi smrti, o katerih so poročali v PSUR 16.
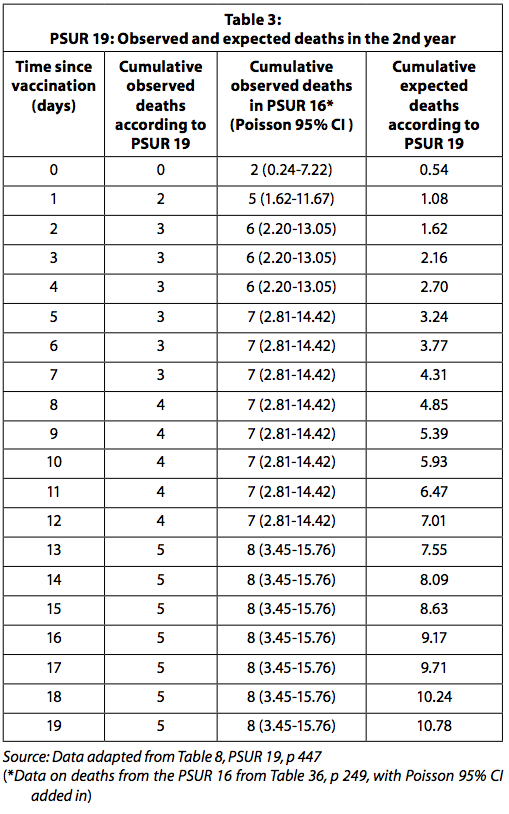
Ko se uporabijo podatki o opaženih smrtnih primerih v PSUR 16, je število opaženih smrtnih primerov bistveno večje od pričakovanih v prvih štirih dneh po cepljenju. Kot je razloženo zgoraj, je treba upoštevati, da ker se število opaženih smrtnih primerov zbira pasivno, je verjetno podcenjeno. Po drugi strani pa so pričakovane smrti verjetno precenjene, saj se izračunajo ob predpostavki, da so bili vsi razdeljeni odmerki uporabljeni brez izgube in nobeno cepivo ni zavrženo, ker je poteklo. GSK bi moral regulativni organ in zdravnike prijaviti statistično značilno povečano tveganje za smrt v štirih dneh po cepljenju.
Odmerki, uporabljeni v drugem letu
PSUR 19 predvideva, da so v drugem letu uporabili 20,2% odmerkov. Navaja, da porazdelitev starosti, pri kateri so preiskovanci cepljeni, ni znana, podjetje pa ugiba, da je delež neželenih dogodkov (vključno s smrtjo) glede na starost reprezentativen za dejansko porazdelitev starosti ob cepljenju. Ker je 20,2% neželenih dogodkov prišlo pri otrocih, starejših od enega leta, je podjetje domnevalo, da je bilo za to starostno skupino uporabljenih 20,2% odmerkov.
Zlahka je oceniti število odmerkov, uporabljenih v drugem letu na podlagi opaženih neželenih dogodkov (vključno s smrtjo), nato pa uporabite to oceno odmerka za izračun pričakovanega števila smrti in ga na koncu primerjajte z opaženim številom smrti - glede na to, da ocena pričakovanih smrti se izračuna predvsem iz opazovanih negativnih dogodkov (vključno s smrtjo).
Ob predpostavki, da so vse smrti po cepljenju sovpadajoče in s povzročiteljem povezanih SIDS / SOUTHS, povezane s cepivom, in glede na to, da je (po PSUR 19) naravna pogostost nenadne smrti v prvem letu 44-krat večja kot v drugem letu (0.441 / 1000 v prvem letu in 0.0102 / 1000 v drugem letu), je treba v drugem letu cepiti 44-krat več otrok, da doseže enako število smrti kot v prvem letu.
Če je v skupini s smrtnimi primeri 100, če se 20% nenadnih smrti zgodi v drugem letu in 80% v prvem letu, mora biti 880 otrok v drugem letu cepljenih na vsakih 20 cepljenih v prvem letu. V tem primeru bi domnevali, da bi 44% vseh odmerkov zdravila Infanrix hexa uporabili v drugem letu, v prvem letu pa le 80% (namesto obratno). To odraža nesmiselnost izračunavanja porazdelitve odmerka glede na starost glede na starostno porazdelitev neželenih dogodkov, kot je navedeno v dokumentu GSK.
Edini način za oceno števila odmerkov, ki so jih uporabili v drugem letu, je pregled shem cepljenja v različnih državah - pregled, katere države priporočajo četrti odmerek v drugem letu in katere odmerke ne priporočajo v drugem letu. Teža se lahko dodeli za število odmerkov, razdeljenih v teh državah. Stopnja osipa (otroci, ki program cepljenja zapustijo po prejemu prvih odmerkov cepiva) je treba upoštevati tudi pri končnem izračunu odstotka odmerkov, uporabljenih v drugem letu. Zdi se, da je razumna ocena odmerkov, uporabljenih v drugem letu, 9,4% skupnih odmerkov in to je številka, uporabljena v PSUR 15.
Etična dilema - težava z vozički
Ta komentar ne poskuša preučiti, ali lahko te prekomerne smrti po cepljenju (verjetno povzročene s cepivom) izravnajo življenja, ki jih je bolezen rešila s preventivo, pridobljeno s cepivom. Philippa Foot v svojem klasičnem miselnem eksperimentu, imenovanem dilema z vozički, sprašuje, ali je etično preusmeriti voziček, ki je pobegnil z železniške proge, v katerem bi umrlo pet ljudi na drugem tiru, kjer bi umrl samo eden (11). . V različici dileme z vozički je samski človek na alternativni progi otrok osebe, ki lahko preklopi skladbe.[2] Judith Thomson domneva, da lahko s presaditvijo organov rešijo pet življenj zdravega darovalca in vpraša, ali bi bilo etično, da eno osebo namerno ubijemo, da bi rešili ostalih pet (12). Etika trdi, da konec ne more upravičiti sredstev. Če po cepljenju skrivate smrt, lahko preprečite / odložite oceno varnostnega profila cepiva, kar lahko povzroči več nepotrebnih smrti, kar je težko etično utemeljiti.
Za Indijo
Regulativni organ indijske vlade je generalni indijski nadzornik drog (DCGI). Po pravilih DCGI so v Indiji odobrena tudi zdravila, odobrena v eni ali več državah, kot so ZDA, Združeno kraljestvo, Kanada, Japonska, Avstralija in države Evropske unije (13). Potrebne so samo dodatne študije za oceno vpliva etničnih dejavnikov na učinkovitost, varnost, odmerjanje in odmerjanje zdravil (14).
Pred kratkim so v Indiji objavili študije o imunogenosti in varnosti heksavalentnega kombiniranega cepiva v majhnih preskušanjih (15,16). Poleg tega je indijska pediatrija objavila uvodnik z naslovom "Šestvalentna cepljenja: prihodnost redne imunizacije?" (17), ki je predlagal, da bi to kombinirano cepivo promovirali v Indiji. Nujno je, da se regulativni organ v Indiji zaveda zaskrbljenosti, izražene v tem komentarju poročil PSUR, zlasti ker so nadzorni sistemi v Indiji šibki.
Povzetek in zaključek
Von Kries (1) je v dveh dneh po cepljenju s zdravilom Hexavac® (eno od dveh odobrenih heksavalentnih cepiv, ki sta zdaj umaknjena) statistično značilno povečala SMR pri otrocih v drugem letu življenja.
V periodičnih posodobljenih poročilih o varnosti GSK, proizvodno podjetje Infanrix hexa, oceni, ali je število nenadnih smrti, o katerih so poročali po cepljenju s svojim zdravilom, preseglo število, ki bi ga lahko pričakovali po naključju. Razvrščanje smrti takoj po imunizaciji kaže na to, da je smrt lahko povzročilo cepivo.
Poleg tega naša analiza kaže, da so bile smrti, ugotovljene v PSUR 16, odstranjene iz PSUR 19. O ugotovljenih smrtnih primerih se spontano poroča GSK in jih je verjetno podcenjevati. Z dodajanjem smrti, odstranjenih iz PSUR 16, se v prvih štirih dneh po cepljenju statistično pomembno poveča tveganje smrti v primerjavi s pričakovanimi smrtnimi primeri. Proizvajalci bodo morali razložiti, zakaj te smrti niso bile vključene v PSUR 19. Povečano tveganje smrti ni bilo razkrito regulativnemu organu ali zdravstvenemu osebju, ki upravlja to cepivo.
Glede na zgoraj navedeno je težko razumeti, kako je EMA morda sprejela PSUR 19 nominalno. Trdimo lahko, da se skrbna skrb ni izvajala, tako da so bili mnogi otroci po nepotrebnem izpostavljeni tveganju smrti.
DCGI je treba opozoriti na omejitve Infanrix Hexa PSUR.

