Může vakcína proti pásovému oparu způsobit zranění a/nebo smrt?

Následující článek se pokouší osvětlit rozsáhlý svět nežádoucích účinků, se specifickým pohledem na ten proti herpes zoster, ale vyzýváme vás, abyste si přečetli všechna níže uvedená zaměření, abyste porozuměli dalším souvisejícím problémům, jako je problém mnohočetných vakcíny, přecitlivělost na jednu nebo více sloučenin vakcíny, problém SIDS a adjuvans.
Problém více vakcín (kliknutím otevřete)
Problém více vakcín

Současné očkovací kalendáře, zejména pro dětský věk, počítají s podáním více antigenů a vakcín v jednom sezení, což zvýhodňuje komfort na úkor bezpečnosti. Abychom mohli pronést konkrétní projev o bezpečnosti vakcín, musíme nutně vzít v úvahu složitost tohoto fenoménu a doporučit všem čtenářům, aby se dostatečně informovali o všech aspektech očkování, výhodách a nevýhodách.
Dr. Russell Blaylock, klinický asistent profesora neurochirurgie na University of Mississippi Medical Center, léta studoval "toxickou synergii" a byl schopen pozorovat, že když dva slabě toxické pesticidy, kde ani jeden není schopen způsobit Parkinsonův syndrom u pokusných zvířat, se vzájemně kombinují, mohou způsobit onemocnění i rychle a srovnává tento jev s jevem více vakcín podaných současně: "Očkování, pokud je příliš mnoho a příliš blízko u sebe, se chovají jako chronické onemocnění".(). Ostatní Dvě studie potvrdily, že náhlá smrt kojence může nastat po naočkování více vakcín v jednom podání.(před naším letopočtem)
Studie publikovaná v Human and Experimental Toxicology ukázala, že země, které dětem předepisují více vakcín, mívají vyšší kojeneckou úmrtnost.(D) Například ve Spojených státech, kde děti dostávají 26 vakcín, zemře více než 6 dětí na 1000 12 živě narozených dětí, zatímco ve Švédsku a Japonsku, kde je aplikováno 3 dětských vakcín, jsou hlášena 1000 úmrtí na každých XNUMX XNUMX živě narozených dětí. Ve výše uvedené studii je také zvažována souvislost mezi vakcínami a SIDS.
Ze švýcarské studie publikované v roce 2005 v European Journal of Pediatrics(E) z toho vyplývá, že pokud jde o účinky na předčasně narozené děti, je výskyt recidivující nebo zvýšené apnoe a bradykardie po podání hexavalentních vakcín 13 %. Ten samý rok publikoval stejný časopis německou studii, která zkoumala náhlá úmrtí kojenců po šestimocném. Autoři píší: «Tyto výsledky, založené na spontánních zprávách, neprokazují kauzální vztah mezi očkováním a náhlým úmrtím kojence, ale představují signál týkající se jednoho ze dvou dostupných hexavalentů; signál, který by měl vést k intenzivnějšímu sledování náhlých úmrtí kojenců po očkování“.(F)
V roce 2006 byla publikována v lékařském časopise Vaccine(G) dopis od týmu výzkumníků z Mnichovské univerzity, který hlásil „šest případů náhlého úmrtí kojenců po šestimocném očkování. Všechny byly nalezeny mrtvé bez vysvětlení 1-2 dny po očkování“. Byly klasifikovány jako typické případy náhlého úmrtí kojenců, ale autoptické ověření odhalilo neuropatologické a histologické abnormality a všechny děti vykazovaly významný otok mozku, což z nich činilo výjimku ve srovnání s ostatními případy SIDS (Syndrom náhlého úmrtí dětí). Vědci napsali, že „Před zavedením hexavalentní vakcíny (v letech 1994-2000) jsme pozorovali případ pouze jednoho ze 198 dětí s náhlým úmrtím kojence, které zemřelo brzy po očkování proti DTP. V letech 2001 až 2004 však identifikovali pět podobných případů ze 74 se SIDS. To by znamenalo třináctinásobný nárůst.“
Také v roce 2006 na Virchows Archive(H), tým z Ústavu patologie Univerzity v Miláně napsal: «Odborníci z Evropské agentury pro hodnocení léčivých přípravků analyzovali možnost, že by mohla existovat souvislost mezi šestivalentními vakcínami a některými případy úmrtí. Mezi účastníky byli patologové se zkušenostmi s vakcínami a syndromem náhlého úmrtí kojenců, kteří prováděli pitvy. Pokud však víme, vyšetření mozkového kmene a krevního srdce na sériových řezech byla věnována malá pozornost a neexistovala možnost stanovit spouštěcí roli. vakcíny pro tato úmrtí. Zde uvádíme případ 3měsíční holčičky, která náhle zemřela po šestimocném očkování. Vyšetření mozkového kmene na sériových řezech odhalilo oboustrannou hypoplazii nucleus arcuate. Převodní systém srdce měl přetrvávající fetální disperzi a degeneraci. Tento případ nabízí jedinečné pochopení možné role hexavalentní vakcíny při vyvolání smrtelných následků u zranitelného dítěte. Jakýkoli případ náhlé a neočekávané smrti, ke kterému dojde brzy po narození nebo v raném dětství, zejména po očkování, by měl vždy projít úplnou pitvou podle pokynů.
Reference
- Blaylock R, "Očkování: skrytá nebezpečí", The Blaylock Wellness Report, květen 2004, s. 1-9
- Ottaviani G. et al., "Syndrom náhlého úmrtí kojenců (SIDS) krátce po hexavalentní vakcinaci: další patologie při podezření na SIDS?", Vircows Archiv., 2006, 448, pp. 100-104.
- Zinka B. et al., "Nevysvětlené případy náhlé smrti kojenců krátce po hexavalentní vakcinaci", Vaccine, červenec 2006, 24 (31-32), str. 5779-5780.
- Miller NZ a kol. ,“Míra kojenecké úmrtnosti klesla proti počtu dávek vakcíny běžně podávaných: existuje biochemická nebo synergická toxicita??", Hum. Exp. Toxicol., květen 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
Problém hliníku (kliknutím otevřete)
Hliník ve vakcínách: co rodiče potřebují vědět

1. Co je hliník?
Hliník je stříbřitě bílý lehký kov, tvárný a odolný. Díky těmto vlastnostem je použitelný v mnoha průmyslových odvětvích a výrobcích, včetně strojů, stavebnictví, skladů, nádobí, kuchyňského náčiní, textilu, barviv a kosmetiky. Hliník je také nejrozšířenějším kovem v zemské kůře a prakticky veškerý hliník v životním prostředí se nachází v půdě. Hliník se však přirozeně nenachází ve významných množstvích v živých organismech (jako jsou rostliny a zvířata) a nemá žádnou známou biologickou funkci. V průběhu minulého století vedlo používání hliníku v některých výrobcích ke zvýšené expozici člověka. Hlavními zdroji expozice jsou potraviny obsahující hliník (např. prášek do pečiva, zpracované potraviny, kojenecká výživa atd.), lékařské produkty (např. antiperspiranty, antacida atd.), injekce proti alergii a vakcíny.1-3
2. Proč je hliník přítomen ve vakcínách?
Některé vakcíny používají jako adjuvans sloučeniny hliníku (hydroxid hlinitý a fosforečnan hlinitý), což jsou složky, které zvyšují imunitní odpověď na antigen (cizí látku).4-5 Americký úřad pro potraviny a léčiva (FDA) říká, že pokud by některé vakcíny neobsahovaly hliník, imunitní odpověď, kterou spouštějí, by se mohla snížit.6
3. Které vakcíny obsahují hliník?
Následující vakcíny obsahují hliník a podávají se kojencům, dětem a dospívajícím (obr. 1):
- Hepatitida B (HepB)
- šestimocný
- Záškrt, tetanus a černý kašel (DTaP a Tdap)
- Haemophilus influenzae typ b (PedvaxHIB)
- Pneumokok (PCV)
- Hepatitida A (HepA)
- Lidský papilomavirus (HPV)
- Meningokok B (MenB)
Obrázek 1: Od narození do 18 let se aplikuje až 22 dávek vakcín obsahujících hliník7-8
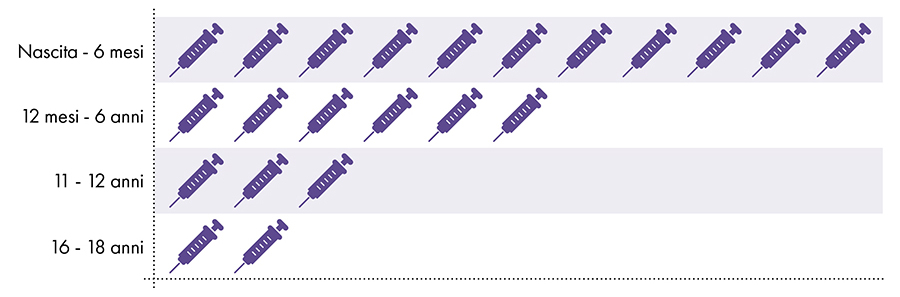
4. Je vystavení hliníku bezpečné?
FDA od roku 1975 považuje hliník obecně za bezpečný (GRAS).9 Před rokem 1990 však neexistovala žádná technologie, která by přesně detekovala malá množství hliníku podávaného subjektům ve vědeckých studiích.10 V důsledku toho nebylo známo množství hliníku, které by mohlo být absorbováno před nástupem nepříznivých účinků.
Od 1990. let XNUMX. století bylo díky technologickému pokroku pozorováno, že malé množství hliníku, které zůstává v lidském těle, zasahuje do řady buněčných a metabolických procesů v nervovém systému a tkáních jiných částí těla.1-10-11 Největší negativní účinky hliníku byly pozorovány v nervovém systému a sahají od zhoršené motoriky až po encefalopatii (změněný duševní stav, změny osobnosti, poruchy myšlení, ztráta paměti, záchvaty, kóma a další).2-12
Ministerstvo zdravotnictví a sociálních služeb Spojených států amerických (HHS) uznává hliník jako známý neurotoxin.2 Kromě toho FDA varoval před riziky toxicity hliníku u kojenců a dětí.13
FEDERÁLNÍ REGISTR: Deník vlády Spojených států"I donošení kojenci s normální funkcí ledvin mohou být ohroženi rychlým růstem a nezralostí mozku a skeletu a také nezralostí hematoencefalické bariéry. Do 1. až 2. roku věku mají kojenci nižší glomerulární filtrace než u dospělých, což ovlivňuje jejich funkci ledvin. Agentura se obává, že malé děti a osoby s nezralou funkcí ledvin jsou vystaveny zvýšenému riziku expozice hliníku.“ |
5. Kolik orálního hliníku není bezpečné?
V roce 2008 Agentura pro registr toxických látek a nemocí (ATSDR), divize HHS, použila studie o neurotoxických účincích hliníku k určení, že ne více než 1 miligram (1.000 XNUMX mikrogramů) hliníku na kilogram tělesné hmotnosti za den. vyhnout se negativním účinkům hliníku.2
6. Jaké množství vstřikovaného hliníku není bezpečné?
Pro stanovení množství hliníku, které lze bezpečně vstříknout, je nutné převést orální limit hliníku podle ATSDR. Limit ATSDR pro perorální hliník (1.000 0,1 mikrogramů hliníku na kilogram tělesné hmotnosti za den) je založen na XNUMX % perorálního hliníku, který je absorbován do krevního řečiště, protože trávicí trakt blokuje téměř veškerý perorální hliník.2 Naopak hliník injikovaný intramuskulárně obchází trávicí trakt a 100 % hliníku se může časem vstřebat do krevního řečiště (tj. podíl absorbovaného hliníku je 1.000krát větší). Aby byla zohledněna tato různá množství absorpce, musí se orální limit hliníku ATSDR vydělit 1000 1. Tento převod vede k limitu hliníku v krvi odvozenému z ATSDR ve výši 0,1 mikrogram hliníku (1.000 % z 1 3 mikrogramů) na kilogram tělesné hmotnosti. denně. Aby se předešlo neurotoxickým účinkům hliníku, nemělo by se denně do krevního oběhu dostat více než XNUMX mikrogram hliníku na kilogram tělesné hmotnosti. Obrázek XNUMX ukazuje limit hliníku v krvi odvozený od ATSDR pro kojence různého věku na základě jejich hmotnosti.
7. Kolik hliníku je ve vakcínách?
Množství hliníku ve vakcínách se liší.16 V roce 1968 federální vláda USA stanovila limit pro množství hliníku ve vakcínách na 850 mikrogramů na dávku na základě množství hliníku potřebného k tomu, aby byly některé vakcíny účinné.6-17 V důsledku toho se množství hliníku v kojeneckých vakcínách obsahujících hliník pohybuje od 125 do 850 mikrogramů na dávku. Obrázek 4 ukazuje obsah hliníku v jedné dávce různých vakcín podaných dětem.
8. Srovnávaly nějaké studie množství hliníku ve vakcínách s limitem odvozeným od Agentury pro registr toxických látek a nemocí (ATSDR)?
V roce 2011 byla publikována studie, která měla za cíl porovnat množství hliníku ve vakcínách s limitem průtoku krve stanoveným ATSDR.18 Tato studie však nesprávně založila své výpočty na 0,78 % perorálního hliníku absorbovaného do krevního řečiště, spíše než na hodnotě 0,1 %, kterou používá ATSDR ve svých výpočtech.19-20 V důsledku toho studie z roku 2011 předpokládala, že téměř 8krát (0,78 % / 0,1 %) se hliník může bezpečně dostat do krevního oběhu, což vedlo k nesprávnému závěru.
9. Je expozice hliníku z vakcín bezpečná?
Vakcíny se aplikují intramuskulárně a rychlost, jakou hliník z vakcín migruje z lidských svalů do krevního řečiště, není známa. Studie na zvířatech naznačují, že hliníku z vakcín může v důsledku mnoha proměnných trvat několik měsíců až více než rok, než se dostane do krevního řečiště.21-23 Vzhledem k tomu, že kumulativní expozice hliníku z vakcín u dětí mladších jednoho roku překračuje denní limit stanovený ATSDR o několik stovek (obr. 3 a 4), byl by limit stále překročen, pokud by se hliník z vakcín dostal do krevního oběhu v průběhu asi rok. Některé studie navíc ukázaly, že hliník z vakcín je absorbován imunitními buňkami a dostává se do částí těla daleko od místa vpichu, včetně mozku.24
Rozsah nepříznivých účinků hliníku ve vakcínách není znám, protože nebyly provedeny bezpečnostní studie srovnávající populaci očkovanou vakcínami obsahujícími hliník s populací neočkovanou takovými vakcínami.
Hliníkové omezení průtoku krve odvozené z ATSDR2-14-15
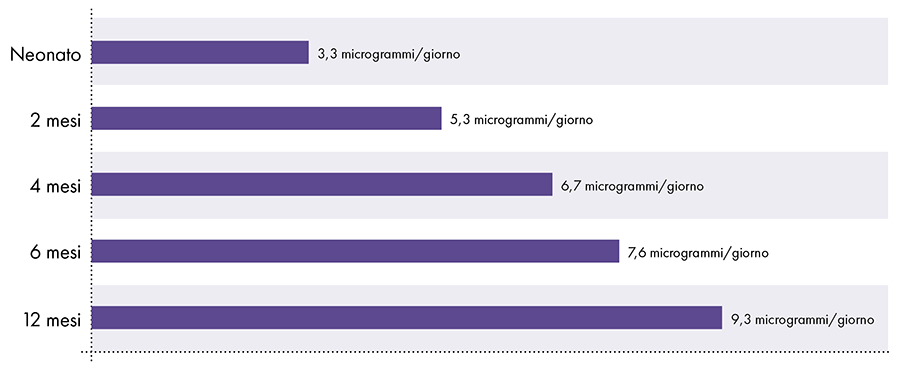 Obrázek 3: Tento graf ukazuje limit hliníku pro děti různého věku, jak je odvozen z Registru toxických látek a nemocí, divize Ministerstva zdravotnictví a sociálních služeb Spojených států amerických. Limit udává, že do krevního oběhu by se denně nemělo dostat více než 1 mikrogram hliníku na kilogram tělesné hmotnosti, aby se předešlo neurotoxickým účinkům hliníku.
Obrázek 3: Tento graf ukazuje limit hliníku pro děti různého věku, jak je odvozen z Registru toxických látek a nemocí, divize Ministerstva zdravotnictví a sociálních služeb Spojených států amerických. Limit udává, že do krevního oběhu by se denně nemělo dostat více než 1 mikrogram hliníku na kilogram tělesné hmotnosti, aby se předešlo neurotoxickým účinkům hliníku.
Množství hliníku ve vakcínách
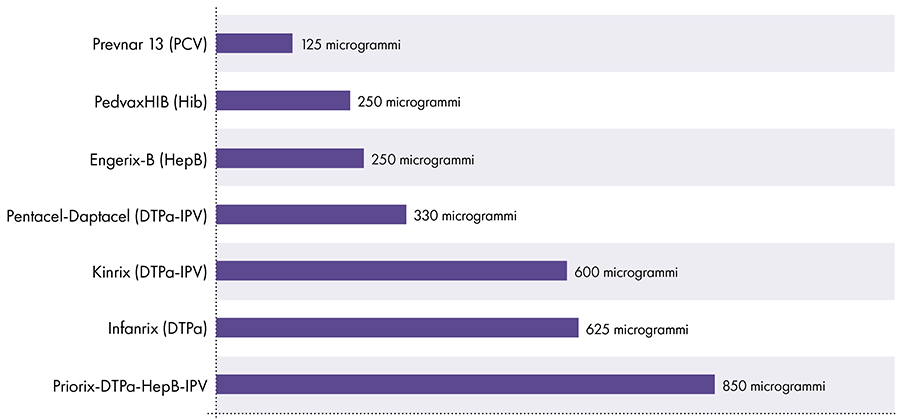
Reference
- Americká akademie pediatrie, Výbor pro výživu. Toxicita hliníku u kojenců a dětí. Pediatrie. březen 1996, 97 (3): 413.
- Agentura pro registr toxických látek a nemocí (ATSDR). Toxikologický profil pro hliník. Washington, DC: Ministerstvo zdravotnictví a sociálních služeb USA; 2008.3, 13-24, 145, 171-7, 208.
- Yokel RA. Hliník v potravinách – povaha a přínos potravinářských přídatných látek. In: El-Samragy Y, editor. Potravinová přísada. Rijeka (Chorvatsko): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. K pochopení adjuvantního působení hliníku. Nat Rev Immunol. 2009. dubna 9 (4): 287.
- Volk VK, Bunney WE. Imunizace proti záškrtu tekutým toxoidem a toxoidem vysráženým kamencem. Am J Veřejné zdraví Zdraví národů. července 1942, 32 (7): 690-9.
- Baylor NW, Egan W, Richman P. Hliníkové soli ve vakcínách – perspektiva USA. Vakcína. 2002. května 31, 20 Suppl 3: S18-22.
- US Food and Drug Administration. Silver Spring (MD): US Food and Drug Administration. Vakcíny licencované pro použití ve Spojených státech amerických; [aktualizováno 2018. února 14; citováno 2018. února 27]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Centra pro kontrolu a prevenci nemocí. Washington, DC: Ministerstvo zdravotnictví a sociálních služeb USA. Doporučené schéma imunizace pro děti a dospívající ve věku 18 let nebo mladší, Spojené státy americké, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- US Food and Drug Administration. Silver Spring (MD): US Food and Drug Administration. SCOGS (Výběrový výbor pro látky GRAS); [citováno 2018. srpna 16]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Kněz ND. Biologické chování a biologická dostupnost hliníku u člověka, se zvláštním odkazem na studie využívající hliník-26 jako indikátor: přehled a aktualizace studie. J Environ Monit. 2004;6: 376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. Hliník ve výrobcích pro parenterální výživu dětí: měřeno versus obsah na etiketě. J Pediatr Pharmacol Ther. 2011, 16 (2): 92-7.
- Sedman A. Toxicita hliníku v dětství. Pediatr Nephrol. 1992 (6): 4-383, červenec 93.
- US Food and Drug Administration, Department of Health and Human Services. Pravidla a regulace. Registrátor Fedu. června 2003, 68 (100): 34286.
- Centra pro kontrolu a prevenci nemocí. Washington, DC: Ministerstvo zdravotnictví a sociálních služeb USA. Národní centrum pro zdravotní statistiku: Tabulka dat pro chlapce v grafech délky k věku a hmotnosti k věku; [citováno 2019. dubna 2]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Centra pro kontrolu a prevenci nemocí. Washington, DC: Ministerstvo zdravotnictví a sociálních služeb USA. Národní centrum pro zdravotní statistiku: Tabulka dat pro grafy délky dívek na věk a hmotnosti na věk; [citováno 2019. dubna 2]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- US Food and Drug Administration, Department of Health and Human Services. Revize požadavků na základní materiály. Konečné pravidlo. Registrátor Fedu. 2011. dubna 13, 76 (71): 20513-8.
- Úřad federálního rejstříku, Národní archivy a spisová služba, Správa všeobecných služeb. Pravidla a regulace. Registrátor Fedu. 1968 leden; 33 (6): 369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Aktualizovaná farmakokinetika hliníku po expozici kojenců prostřednictvím stravy a očkování. Vakcína. 2011. listopadu 28, 29 (51): 9538-43.
- Miller S, lékaři pro informovaný souhlas. Erratum v 'Aktualizovaná farmakokinetika hliníku po expozici kojenců prostřednictvím diety a očkování.' In: ResearchGate. Berlín (Německo): ResearchGate GmbH; 2020. března 6 [citováno 2020. března 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Lékaři pro informovaný souhlas. Newport Beach (CA): Lékaři pro informovaný souhlas. Erratum v „Aktualizovaná farmakokinetika hliníku po expozici kojenců prostřednictvím diety a očkování“; [citováno 2020. března 6]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. In vivo absorpce adjuvans vakcín obsahujících hliník pomocí 26Al. Vaccine 1997 srpen-září, 15 (12-13): 1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Test hliníku a hodnocení lokální reakce v několika časových bodech po intramuskulárním podání vakcín obsahujících hliník u opice Cynomolgus. Vakcína. 2005. února 3, 23 (11): 1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanislawski B. Hliník v plazmě a tkáních po intramuskulární injekci lidských vakcín s adjuvans u potkanů. Arch Toxicol. říjen 2019, 93 (10): 2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. Kritická analýza referenčních studií toxikokinetiky adjuvans na bázi hliníku. J Inorg Biochem. 2018 duben; 181: 87-95.
Článek přeložil Lékaři pro informovaný souhlas
Podle příbalového letáku vakcíny Shingrix zahrnovaly nežádoucí účinky hlášené během klinické studie bolest, otok a zarudnutí v místě vpichu, bolest hlavy, horečku, únavu, zimnici, gastrointestinální potíže, dnu a ischemickou neuropatii zrakového nervu.(1) Společnost GlaxoSmithKline se zavázala provést několik postmarketingových studií pro vakcínu SHINGRIX, na kterou získala licenci v roce 2017. Podle údajů předložených americkým centrem pro kontrolu a prevenci nemocí (CDC) na červnovém zasedání Poradního výboru pro imunizační postupy (ACIP) v roce 2018. Většina zprávy se týkaly žen a nejednalo se o závažné události; nejčastější reakcí byla bolest v místě vpichu.(2)
Na schůzce ACIP v únoru 2019 Dr. Tom Shimabukuro z Úřadu pro bezpečnost imunizace CDC (ISO) oznámil potenciální bezpečnostní signál s vakcínou SHINGRIX. Souvislost mezi syndromem Guillain Barré (GBS) a vakcínou byla nalezena ve Vaccine Safety Datalink (VSD) a Vaccine Adverse Events Reporting System (VAERS). GBS je vzácné neurologické onemocnění, které způsobuje zánět periferních nervů. Komplikace mohou zahrnovat dočasné nebo chronické ochrnutí, včetně úplného ochrnutí těla.(3)
CDC, FDA a Centra pro Medicare a Medicaid Services (CMS) provedly revizi dat z databáze nároků Medicare. Podle FDA:(4) "Riziko GBS po očkování Shingrixem bylo hodnoceno v analýzách samokontrolovaných sérií případů s použitím rizikového okna 1 až 42 dnů po očkování a kontrolního okna 43 až 183 dnů po očkování. Primární analýza zjistila zvýšené riziko GBS během 42 dnů po očkování vakcínou Shingrix, s odhadem 3 případy nadměrného výskytu GBS na milion dávek podaných dospělým ve věku 65 let a starším. Zvýšené riziko GBS bylo pozorováno během 42 dnů po první dávce vakcíny Shingrix s odhaduje se 6 případů nadměrného výskytu GBS na milion dávek podaných dospělým ve věku 65 let a starším, přičemž žádné zvýšené riziko GBS po druhé dávce Shingrixu. Tyto analýzy diagnóz GBS v datech nároků byly podpořeny analýzami případů GBS potvrzenými přezkoumáním lékařských záznamů ."
FDA navázala spojení mezi Shingrixem a GBS, ale sdělila, že aktuální údaje nejsou k dispozici pro stanovení kauzálního vztahu. Nicméně, k závěru, že revize oddílu "Varování a bezpečnostní opatření" příbalové informace SHINGRIX o riziku GBS byla oprávněná.(5)
Další nežádoucí účinky hlášené po schválení vakcíny Shingrix zahrnovaly alergické reakce, angioedém, kopřivku a vyrážku a sníženou pohyblivost v rameni vakcíny.(6)
Nežádoucí účinky hlášené v klinických studiích nebo po uvedení vakcíny Zostavax na trh zahrnují bolest, otok a zarudnutí v místě vpichu, bolest hlavy, kožní vyrážku podobnou pásovému oparu, horečku, šok, bolest kloubů a svalů, otoky uzlin a respirační příznaky.(7) V publikované případové studii byla také hlášena optická neuritida po podání vakcíny Zostavax.(8)
V příbalovém letáku Zostavaxu je uvedeno, že „může dojít k přenosu viru vakcíny mezi očkovanými a vnímavými kontakty,“(9) to znamená, že očkovaný jedinec je infekční planými neštovicemi vakcinačního kmene a může infikovat ostatní planými neštovicemi, pokud předtím plané neštovice neměl.
Merck, výrobce Zostavaxu, se v současné době brání 60 žalobám, které tvrdí, že vakcína způsobila vážné vedlejší účinky, včetně smrti. Na výsledek tohoto řízení se čeká.(10) Prodej Zostavax ve Spojených státech byl ukončen v listopadu 2020.(11)
Merck, výrobce Zostavaxu, v současnosti žaluje a brání se proti žalobám, které tvrdí, že vakcína způsobila vážné vedlejší účinky, včetně smrti.(12) V prosinci 2022 zamítl federální soudce v Pensylvánii téměř 1.200 tvrzení o pásovém oparu po vakcíně Zostavax. Tvrzení byla údajně zamítnuta soudcem kvůli nedostatku důkazů, že pásový opar souvisel s vakcínou. Další soudní spory kvůli autoimunitním poruchám a ztrátě sluchu probíhají.(13)
Reference (kliknutím otevřete)
- GlaxoSmithKline Biologicals. Příbalový leták - SHINGRIX. US Food and Drug Administration 2. srpna 2021
- Centra pro kontrolu a prevenci nemocí v USA. Červen 2018 ACIP minuty. Červen 2018.
- Wrangham T. ACIP: 2018-2019 vakcína proti chřipce 44 procent účinná. Vakcína Národní informační centrum 7. dubna 2019.
- US Food and Drug Administration. FDA požaduje, aby v informacích o předepisování Shingrixu bylo zahrnuto varování před Guillain-Barrého syndromem (GBS). 24. března 2021.
- US Food and Drug Administration. FDA požaduje, aby v informacích o předepisování Shingrixu bylo zahrnuto varování před Guillain-Barrého syndromem (GBS). 24. března 2021.
- GlaxoSmithKline Biologicals. Příbalový leták - SHINGRIX. US Food and Drug Administration 2. srpna 2021
- Merck & Co. Příbalový leták – Zostavax (mražený). US Food and Drug Administration Prosince 26, 2019.
- Han S. Optická neuritida po očkování Varicella zoster: hlášeny dva případy. Vakcína 3. září 2014; 32(39):4881-4.
- Merck & Co. Příbalový leták – Zostavax (mražený). US Food and Drug Administration Prosince 26, 2019.
- Luhana, R. Společnost Merck podala návrh na konsolidaci soudních sporů o Zostavax na Floridě. Právní zkoušející Může 30, 2018.
- Centra pro kontrolu a prevenci nemocí v USA. Co by měl každý vědět o Zostavaxu. 5. října 2020.
- Luhana, R. Společnost Merck podala návrh na konsolidaci soudních sporů o Zostavax na Floridě. Právní zkoušející Může 30, 2018.
- Kansteiner F. Merck unikl téměř 1,200 soudním sporům o vakcínu proti pásovému oparu Zostavax, protože svědectví žalobců chybí. Fierce Pharma Prosince 8, 2022.
Tento článek shrnuje a překládá Vakcína Národní informační centrum.

