الألومنيوم في أنسجة المخ من المصابين بالتوحد

مجلة العناصر النزرة في الطب والبيولوجيا
المؤلفون: ماثيو مولد ، دوركاس عمر ، أندرو كينج ، كريستوفر إكسلي
26 نوفمبر 2017
ملخص
اضطراب طيف التوحد هو اضطراب في النمو العصبي لمسببات غير معروفة (السبب). يقترح أن السبب ينطوي على كل من القابلية الوراثية والعوامل البيئية ، والتي تشمل أيضا السموم البيئية في النهاية. بذلت محاولات لربط التعرض البشري لتسمم الألومنيوم البيئي باضطراب طيف التوحد. هنا استخدمنا تقنية فرن تسخين الجرافيت المستعرض مستعرضاً بطريقة طيفية (قياس طيف الامتصاص الذري من فرن الجرافيت المسخن مستعرضاً) لقياس المحتوى الألومنيوم لأنسجة المخ لدى المتبرعين مع تشخيص مرض التوحد. كما استخدمنا الفلور الانتقائي للألمنيوم لتحديد الألمنيوم في أنسجة المخ باستخدام المجهر الفلوري. كان محتوى الألومنيوم في أنسجة المخ في مرض التوحد مرتفعًا بلا ريب. كان المتوسط (في الأقواس الانحراف المعياري) لمحتوى الألمنيوم في 5 أفراد لكل شحمة 3,82 (5,42) ، 2,30 (2,00) ، 2,79 (4,05) و 3,82 ، 5,17 (15) ميكروغرام / غرام من وزن المادة الجافة للفصوص القذالي والجبهي والزماني والجداري على التوالي. هذه هي من بين أعلى قيم للألمنيوم في أنسجة المخ البشري التي تم قياسها حتى الآن ويتعين على المرء أن يتساءل لماذا ، على سبيل المثال ، يجب أن يكون محتوى الألمونيوم في الفص القذالي لصبي يبلغ من العمر 8,74 عامًا 11,59 (10) ميكروغرام / غرام وزن المادة الجافة؟ تم استخدام مجهر مضان الألومنيوم انتقائي لتحديد الألومنيوم في أنسجة المخ من XNUMX الجهات المانحة. بينما كان يتصور أن الألومنيوم يرتبط بالخلايا العصبية ، فقد لوحظ أنه موجود في المنطقة داخل الخلايا في خلايا مشابهة للخلايا الدبقية الصغيرة وغيرها من الخلايا الالتهابية غير العصبية في السحايا والأوعية الدموية والمادة الرمادية والمادة البيضاء. كان بروز الألمنيوم داخل الخلايا المرتبط بالخلايا غير العصبية ملاحظة استثنائية في أنسجة المخ من الأشخاص المصابين بالتوحد ويمكن أن يقدم أدلة حول أصل الألمنيوم الموجود في الدماغ وحول الدور المحتمل لهذه المادة في التسبب في اضطراب طيف التوحد.
مقدّمة
اضطراب طيف التوحد (ASD) عبارة عن مجموعة من الحالات المرضية للتطور العصبي لسبب غير معروف. من المحتمل جدًا أن ترتبط كل من العوامل الوراثية [1] والبيئية [2] ببداية وتطور ASD بينما من المتوقع أن تكون الآليات الكامنة وراء ASI متعددة العوامل [3-6]. الاشتباه في تعرض الإنسان للألمنيوم هو سبب ASD لكن الاستنتاجات كانت مشكوك فيها [7-10]. حتى الآن ، استخدمت معظم الدراسات الشعر كمؤشر على تعرض الإنسان للألمونيوم بينما تم استخدام محتوى الألومنيوم في الدم والبول إلى حد محدود. تعد لقاحات الأطفال التي تحتوي على مادة مساعدة من الألومنيوم بمثابة مقياس غير مباشر لتعرض الأطفال الرضع للألمنيوم وقد ارتبط استخدامهم المتزايد ارتباطًا مباشرًا بزيادة معدل الإصابة بـ ASD [11]. تواصل النماذج الحيوانية لـ ASD دعم الاتصال مع المواد المساعدة للألومنيوم والألومنيوم التي تستخدم بشكل خاص في التطعيمات البشرية [12]. حتى الآن ، لا توجد دراسات حول وجود الألومنيوم في أنسجة المخ لدى المتبرعين الذين ماتوا مع تشخيص مرض التوحد. قمنا بقياس كمية الألمنيوم الموجودة في أنسجة المخ من الأشخاص المصابين بالتوحد وحدد موقع الألومنيوم في هذه الأنسجة.
المواد والأساليب
2.1. قياس كميات الألمنيوم في أنسجة المخ
تم الحصول على موافقة أخلاقية مع الأنسجة من "بنك أوكسفورد للمخ" (Oxford Brain Bank - 15 / SC / 0639). تم الحصول على عينات لحاء تساوي حوالي جرام واحد من المواد المجمدة في الفص الصدغي ، الأمامي ، الجداري والقذالي والحصين (0,3 غرام فقط) من 5 أفراد مع تشخيص ASD الذي أكدته ADI-Rconfirmed (Autism Diagnostic Interview - منقحة) ، 4 ذكور وإناث ، تتراوح أعمارهم بين 1 و 15 سنة (الجدول 50). تم قياس محتوى الألومنيوم من هذه الأقمشة عن طريق طريقة موحدة وموثوقة بالكامل [1] والتي تم وصفها هنا فقط لفترة وجيزة.
النتائج
3.1 محتوى الألومنيوم في أنسجة المخ
تراوح محتوى الألمنيوم في جميع الأنسجة من 0,01 (حد القياس الكمي) إلى 22,11 مجم / جم من وزن المادة الجافة. (الجدول 1). تراوح محتوى الألمنيوم للأدمغة ككل (ن = 4 أو 5 اعتمادًا على توافر أنسجة الحصين) من 1,20 (1,06) ملغم / جم مادة جافة للمرأة البالغة من العمر 44 عامًا (A1) ) إلى 4,77 (4,79) ملغم / جم للذكر البالغ من العمر 33 عامًا (A5). سمحت لنا القياسات السابقة للألمنيوم في الدماغ ، بما في ذلك دراستنا لـ 60 دماغًا [15] ، بتحديد فئات محتوى الألمنيوم تقريبًا بدءًا من قيم أقل من أو تساوي 1,00 مجم / جم باعتبارها حميدة من الناحية المرضية (على العكس من ذلك) لمفهوم "العادي"). ما يقرب من 40 ٪ من الأنسجة (24/59) تحتوي على محتوى من الألومنيوم يعتبر مقلقًا من الناحية المرضية (³2,00 مجم /) بينما يحتوي حوالي 67 ٪ من هذه الأنسجة على محتوى من الألومنيوم يعتبر مهمًا من الناحية المرضية (³3,00 مجم / جم) ). تحتوي أدمغة الأفراد الخمسة على نسيج واحد على الأقل يحتوي على نسبة كبيرة من الألمنيوم. كانت أدمغة الأفراد الأربعة تحتوي على نسيج واحد على الأقل يحتوي على محتوى من الألومنيوم أكبر من أو يساوي 5 مجم / جم ، بينما كان لدى 4 منهم نسيج واحد على الأقل يحتوي على محتوى من الألومنيوم أكبر من أو يساوي 5,00 مجم / جم (الجدول 3). كان متوسط محتوى الألومنيوم (الانحراف المعياري بين قوسين) للأفراد الخمسة لكل فص 10,00 (1) ، 5 (3,82) ، 5,42 (2,30) ، و 2,00 ( الشكل 2,79) للفص الجبهي والقذالي والجبهي والصدغي والجداري. لا توجد فروق ذات دلالة إحصائية في محتوى الألمنيوم بين الفصوص الأربعة.
3.2. الإسفار بسبب الألومنيوم في أنسجة المخ
درسنا المقاطع التسلسلية للدماغ من 10 أفراد (3 إناث و 7 ذكور) الذين لقوا حتفهم مع تشخيص ASD وسجلت وجود الألومنيوم في هذه الأنسجة (الجدول S1). ينبعث من الإثارة في مجمع الألومنيوم واللوموجين مضان برتقالي مميز يبدو أصفر ساطع بشكل متزايد مع زيادة شدة التألق. تم تسجيل الألمنيوم ، الذي تم تحديده على أنه رواسب تفاعلية من اللوموجليون ، في نسيج واحد على الأقل في جميع الأفراد العشرة. أكد التألق الذاتي للأقسام التسلسلية المجاورة مباشرة أن مضان اللوموجلين يدل على وجود الألومنيوم. كانت رواسب الألومنيوم أكثر تواتراً في الذكور (129 من أصل 7 أفراد) أكثر من الإناث (21 من 3 أفراد). تم العثور على الألومنيوم في كل من المادة البيضاء (62 رواسب) والمادة الرمادية (88 رواسب). في الإناث ، تم تحديد معظم رواسب الألمنيوم على أنها خارج الخلية (15 من 21) في حين تم العثور على الوضع المعاكس في الذكور مع 80 من أصل 129 رواسب في المنطقة داخل الخلايا. تم تزويدنا بثلاثة أقسام متسلسلة فقط من كل نسيج ، وبالتالي لم نتمكن من إجراء أي تلطيخ يهدف إلى تحديد التشكل العام مما يعني أنه لم يكن من الممكن دائمًا تحديد أي نوع فرعي من الخلايا كان يظهر مضانًا بسبب الألمنيوم . تم التعرف على خلايا الدم البيضاء أحادية النواة المحملة بالألمنيوم ، وربما الخلايا اللمفاوية ، في السحايا وربما كانت تدخل أنسجة المخ من الجهاز اللمفاوي (الشكل. 10). من الواضح أنه يمكن رؤية الألومنيوم داخل الخلايا أو في شكل رواسب نقطية منفصلة ، أو على شكل مضان أصفر كثيف (الشكل. 1). تم توطين الألومنيوم في الخلايا الالتهابية المرتبطة الأوعية الدموية (الشكل. 2). في إحدى الحالات ، لوحظ ما يبدو أنه خلية ليمفاوية أو أحادية الخلية محملة بالألمنيوم داخل وعاء دموي محاط بخلايا الدم الحمراء ، بينما لوحظ وجود خلية ليمفاوية أخرى محتملة تظهر مضانًا أصفر كثيفًا في الغشاء المغامر (الشكل. 2b). غالبًا ما لوحظت الخلايا الدبقية ، بما في ذلك خلايا شبيهة بتلك الموجودة في الخلايا الدبقية الصغيرة التي تظهر مضانًا بسبب وجود الألمنيوم ، في أنسجة المخ بالقرب من الرواسب خارج الخلية الملونة بواسطة الألومنيوم (الشكلان 3 و 4). كانت رواسب الألومنيوم التي يبلغ قطرها حوالي 1 مم مرئية بشكل واضح في كل من الأجسام الدائرية والأميبيوية للخلايا الدبقية (على سبيل المثال تين 3b). تم تحديد الألمنيوم داخل الخلايا في الخلايا والخلايا العصبية المحتملة المشابهة لتلك الموجودة في الدبق ، وغالبًا في المنطقة المجاورة أو في نفس الموقع مثل الليفوفوسين (الشكل. 5). عملت مضان انتقائي للألمنيوم في تحديد الألومنيوم في المواقع خارج الخلية والخلايا في الخلايا العصبية وغير العصبية وفي جميع أنسجة المخ التي شملتها الدراسة (أرقام 1-5). تحدد الطريقة الألومنيوم فقط كما يتضح من المساحات الكبيرة من أنسجة المخ دون أي مضان مميز يشير إلى إيجابية الألمنيوم (الشكل.
خيط
كان محتوى الألمنيوم في أنسجة المخ من المتبرعين الذين تم تشخيص إصابتهم باضطراب طيف التوحد مرتفعًا للغاية (الجدول 1). في حين تم العثور على تباين كبير بين الأنسجة المختلفة ، والفصوص المختلفة ، والموضوعات المختلفة ، كان متوسط محتوى الألمنيوم لكل فص (بين 5 أفراد) في أعلى المستويات لجميع القياسات السابقة لمحتوى الألومنيوم في الدماغ ، بما في ذلك حالات اضطرابات علاجي المنشأ مثل غسيل الكلى [13,15 ، 16 ، 19-4]. كان لدى جميع المتبرعين الذكور الأربعة تركيزات أعلى من الألومنيوم في المخ من المتبرع الوحيد. في هؤلاء الذكور المصابين بالتوحد ، سجلنا بعضًا من أعلى قيم محتوى الألومنيوم في الدماغ التي تم قياسها على الإطلاق في الأنسجة السليمة أو المريضة ، بما في ذلك قيم 17,10 18,57 و 22,11 مجم / جم من المادة الجافة. (الجدول 1). ما يميز هذه البيانات عن التحليلات الأخرى للألمنيوم في الدماغ في أمراض أخرى هو عمر الأفراد المصابين بالتوحد. لماذا ، على سبيل المثال ، قد يكون لدى صبي يبلغ من العمر 15 عامًا نسبة عالية من الألومنيوم في أنسجة دماغه؟ لا توجد بيانات قابلة للمقارنة في الأدبيات العلمية ، وأقرب رقم مشابه هو الرقم لرجل يبلغ من العمر 42 عامًا مصاب "بشكل عائلي" من مرض الزهايمر (FAD) [19]. قدم الفحص المجهري الفلوري الانتقائي للألمنيوم مؤشرات على مواقع ترسيب الألمنيوم في أنسجة الدماغ هذه للأشخاص المصابين بالتوحد (الأشكال 1-5).
تم العثور على الألومنيوم في كل من المادة البيضاء والرمادية وفي كل من المواقع الخلوية والخلوية. هذه الأخيرة كانت واسعة الانتشار بشكل خاص في هذه الأنسجة من الأشخاص المصابين بالتوحد. تم تحديد الخلايا التي ظهرت شكليا غير العصبية ومحملة بشكل كبير مع الألومنيوم والخلايا المرتبطة السحايا (الشكل 1) ، والأوعية الدموية (الشكل 2) وكخلايا المادة الرمادية والمادة البيضاء (أرقام 3-5). ظهرت بعض هذه الخلايا الدبقية (ربما الخلايا النجمية) في حين أن البعض الآخر قد مددت نواة التي أعطت لهم ظهور خلايا الخلايا الدبقية الصغيرة [5]. وقد شوهد هذا الأخير في بعض الأحيان بالقرب من رواسب الألومنيوم خارج الخلية. هذا يعني أن الألومنيوم عبر حاجز الدم في الدماغ بطريقة أو بأخرى وتم نقله من خلية أصلية ، وهي خلية الخلايا الدبقية الصغيرة. ومن المثير للاهتمام أن الوجود العرضي للخلايا الالتهابية المحملة بالألمنيوم في الأوعية الدموية والليبتومينيز يفتح الباب أمام إمكانية وجود طريقة مختلفة لدخول الألمنيوم إلى الدماغ ، أو داخل الخلايا. ومع ذلك ، ولكي يكون هذا السيناريو الثاني صحيحًا ، يتوقع المرء حدوث نوع من التلف داخل المخ للسماح للهروب من الخلايا اللمفية وحيدات من الأوعية الدموية. يعد التعرف على الخلايا غير العصبية ، بما في ذلك الخلايا الالتهابية والخلايا الدبقية والخلايا الدبقية الدبقية ، وكلها محملة بالألمنيوم ، بمثابة ملاحظة استثنائية لـ ASD. على سبيل المثال ، كانت معظم رواسب الألومنيوم المحددة في أنسجة المخ في "الأشكال المألوفة" لمرض الزهايمر خارج الخلية وترتبط دائمًا بالمواد الرمادية [19].
الألمنيوم سام للخلايا [21] ولا يمكن أن يكون ارتباطه (كما هو موضح هنا) بالخلايا الالتهابية في الأوعية الدموية والسحايا والجهاز العصبي المركزي حميداً. الصغر الدبقية المصنوع من الألمنيوم المثقل بالزيت ، رغم أنه قد يظل قابلاً للتطبيق ، على الأقل لبعض الوقت ، سيتم تعرضه للخطر ، ويُعتقد أن ضعف الخلايا الدبقية الصغيرة يشارك في مسببات ASD [22] ، على سبيل المثال في عدم إتساق الأوراق اللاإرادي [23] . بالإضافة إلى ذلك ، فإن حقيقة أن هذه البيانات تشير إلى أن دخول الألمنيوم إلى الدماغ عن طريق خلايا الجهاز المناعي المتداولة في الدم والليمفاوية يمكن تسريعها في الأشخاص المصابين بالتوحد يمكن أن يبدأ في شرح السؤال المطروح أولاً عن سبب وجوده يوجد الكثير من الألومنيوم في دماغ صبي مصاب بالتوحد يبلغ من العمر 15 عامًا. أحد قيود دراستنا هو قلة عدد الحالات المتاحة للتحليل ومحدودية توافر الأنسجة. فيما يتعلق بالعامل الأخير ، فإن الوصول إلى 1 جم فقط من الأنسجة المجمدة و 3 أقسام متسلسلة فقط من الأنسجة الثابتة في الفص يمكن اعتباره قيدًا كبيرًا. بالتأكيد إذا لم نحدد أي رواسب كبيرة من الألومنيوم في عينة صغيرة من الأنسجة (يتراوح متوسط كتلة المخ بين 1.500 و 2.000 جم) فإن هذه النتيجة ستكون ملتبسة. ومع ذلك ، فإن حقيقة أننا وجدنا الألومنيوم في كل عينة من الأنسجة ، مجمدة أو مجمدة ، تشير بقوة إلى أن الأفراد الذين تم تشخيص إصابتهم بـ ASD لديهم مستويات عالية بشكل غير عادي من الألومنيوم في أنسجة المخ وأن هذا الألومنيوم يرتبط بشكل بارز بالخلايا غير العصبية المدرجة تلك الخلايا الدبقية الصغيرة وغيرها من حيدات الالتهابات.
الاستنتاجات
لقد قمنا بإجراء القياس الأول لمحتوى الألومنيوم في أنسجة المخ في الأشخاص المصابين بالتوحد وأظهرنا أن محتوى الألمنيوم في الدماغ مرتفع للغاية. حددنا الألمنيوم في أنسجة المخ في كل من المناطق خارج الخلية وداخل الخلايا (سواء في الخلايا العصبية والخلايا غير العصبية). إن وجود الألومنيوم في الخلايا الالتهابية في السحايا ، في الأوعية الدموية ، في اللونين الرمادي والأبيض هو ملاحظة استثنائية ويمكن أن يثبت دور سبب للألمنيوم في مسببات ASD.
PSUR 16: مضاعفة عدد الوفيات المتوقعة
إذا تلقى جميع الأطفال الذين تلقوا الجرعة الأولى من اللقاح ما مجموعه أربع جرعات وتم إعطاء آخر جرعة في السنة الثانية من العمر ، فيمكن تقدير أن ربع (25٪) الجرعات تُعطى للأطفال الأكبر سناً إلى سنة. هذا هو جدول التطعيم الموصى به في ألمانيا. ومع ذلك ، فإن بعض الدول ، مثل إيطاليا ، توصي بثلاث جرعات فقط ، جميعها في السنة الأولى ، ولا يوجد في الثانية. بالإضافة إلى ذلك ، لا يتلقى جميع الأطفال جميع الجرعات الموصى بها. حتى 20-25 ٪ من الجرعات من غير المرجح أن تستخدم في السنة الثانية. في PSUR 15 ، تم تقدير أن 90,6 ٪ من الجرعات المباعة استخدمت في الأطفال دون سن سنة واحدة و 9,4 ٪ للذين تزيد أعمارهم عن سنة واحدة. في PSUR 16 ، ارتفع تقدير الجرعات المستلمة في السنة الثانية بأكثر من الضعف (من 9,4 ٪ إلى 20 ٪) ، وبالتالي تضاعف تقدير الوفيات المتوقعة. على الرغم من مضاعفة الوفيات المتوقعة ، كان عدد الوفيات التي لوحظت في السنة الثانية أعلى من المتوقع في الأيام الثلاثة الأولى بعد التطعيم (الجدول 3 ، صفحة 36). إذا كانت التقديرات في PSUR 249 بأن 15٪ من الجرعات تستخدم في السنة الثانية صحيحة ، فإن هذا ينطبق أيضًا على PSUR 9,4 ، وبالتالي فإن الوفيات المرصودة أعلى من الوفيات المتوقعة في الأيام السبعة الأولى.
تضارب المصالح
يعلن المؤلفون أنه ليس لديهم تضارب في المصالح
شكر وتقدير
ويدعم البحث بتمويل من معهد بحوث السلامة الطبية للأطفال (CMSRI)، وهي مؤسسة غير ربحية مقرها واشنطن العاصمة ، الولايات المتحدة الأمريكية تتعامل مع الأبحاث
المراجع
- A. Krishnan، R.Zhang، V. Yao، CLTheesfeld، AK Wong et al.، التنبؤ على نطاق الجينوم والتوصيف الوظيفي للأساس الجيني لاضطراب طيف التوحد ، علم الأعصاب الطبيعي 19 (2016) 1454-1462.
- LA Sealey، BW Hughes، AN Sriskanda، JR Guest، AD Gibson et al.، العوامل البيئية في تطور اضطرابات طيف التوحد ، Environ. الباحث 88 (2016) 288-298.
- ر. كوياما ، Y. Ikegaya ، Microglia في التسبب في اضطرابات طيف التوحد ، Neurosci. القرار 100 (2015) 1-5.
- كيو لي Zhou ، محور microbota-gut-brain ودورها العلاجي المحتمل في اضطراب طيف التوحد ، العلوم العصبية 324 (2016) 131-139.
- C. Kaur، G. Rathnasamy، EA. لينغ ، بيولوجيا الخلايا الدبقية الصغيرة في الدماغ النامية ، J. Neuropathol Exp. Neurol. 76 (2017) 736-753.
- M. Varghese، N. Keshav، S. Jacot-Descombes، T. Warda، B. Wicinski et al.، Autism spectrum disorder: neuropathology and animal models، Acta Neuropathol. 134 (2017) 537- 566.
- H. Yasuda ، Y. Yasuda ، T. Tsutsui ، تقدير الأطفال المصابين بالتوحد من خلال تحليل المعادن ، العلوم 3 ، 2013).
- FEB Mohamed، EA Zaky، AB El-Sayed، RM El الحسيني، SS Zahra et al.، تقييم ألومنيوم الشعر والرصاص والزئبق في عينة من الأطفال المصريين المصابين بالتوحد: عوامل الخطر البيئية للمعادن الثقيلة في مرض التوحد ، Neurol السلوكي. (2015) المادة 545674.
- MH Rahbar، M. Samms-Vaughn، MR Pitcher، J. Bressler، M. Hessabi et al.، دور الجينات الأيضية في تركيزات الألومنيوم في الدم لأطفال الجامايكيين المصابين باضطراب طيف التوحد وبدونه ، Int. J. Environ. القرار الصحة العامة 13 (2016) 1095.
- AV Skalny، NV Simashkova، TP Klyushnik، AR Grabeklis، IV Radysh et al.، تحليل العناصر النزرة للشعر في الأطفال الذين يعانون من اضطرابات طيف التوحد واضطرابات التواصل، Trace Elem Med. Biol. 177 (2017) 215-223.
- توملينوفيتش ، كاليفورنيا شو ، هل تساهم مواد مساعدة لقاح الألمنيوم في ارتفاع معدل انتشار مرض التوحد؟ ، ج. إينورج. الكيميائية الحيوية. 105 (2011) 1489-1499.
- يرتبط CA Shaw، Y. Li، L. Tomljenovic، إدارة الألمنيوم إلى فئران الولدان بكميات ذات صلة باللقاحات بالنتائج العصبية الضارة طويلة المدى ، J. Inorg. الكيميائية الحيوية. 128 (2013) 237-244
- E. House، M. Esiri، G. Forster، P. Ince، C. Exley، Aluminium، iron and copper في أنسجة المخ البشري المتبرع بها للدراسة المعرفية للشيخوخة في مجلس البحوث الطبية ، دراسة الشيخوخة ، Metallomics 4 (2012) 56-65.
- M. Mold، H. Eriksson، P. Siesjö، A. Darabi، E. Shardlow، C. Exley، Identification لا لبس فيه من مادة الألومنيوم المساعدة داخل الخلايا في خط خلية أحادي THP-1 ، Sci. Rep. 4 (2014) 6287.
- A. Mirza، A. King، C. Troakes، C. Exley، التعرف على الألمنيوم في أنسجة المخ البشري باستخدام المجهر اللوميولوجي والفلوري، J. Alzh. ديس. 54 (2016) 1333-1338.
- C. Exley، M. Esiri، اعتلال وعائي دماغي شديد شديد متزامن مع زيادة الألمنيوم في الدماغ في أحد سكان كاملفورد ، كورنوال ، المملكة المتحدة ، J. نيورول. Neurosurg. الطب النفسي 77 (2006) 877-879.
- C. Exley ، ER البيت ، الألومنيوم في الدماغ البشري ، Monatsh. علم. 142 (2011) 357- 363.
- C. Exley، T. Vickers، ألومنيوم دماغ مرتفع وظهور مبكر لمرض الزهايمر لدى فرد معرض مهنيا للألمنيوم: تقرير حالة ، J. Med. Case Rep. 8 (2014) 41.
- A. Mirza ، A. King ، C. Troakes ، C. Exley ، الألومنيوم في أنسجة المخ في مرض الزهايمر العائلي ، J. Trace Elem Med. Biol. 40 (2017) 30-36.
- R. Shechter، O. Miller، G. Yovel، N. Rosenzweig، A. London et al.
- C. Exley ، سمية الألومنيوم في البشر ، Morphologie 100 (2016) 51-55.
- MW سالتر ، B. ستيفنز ، Microglia يبرز لاعبين أساسيين في أمراض الدماغ ، نات. 23 (2017) 1018-1027.
- U. Neniskyte، CT Gross، Errant gardeners: التقليم المتشابك المعتمد على الخلايا الدبقية واضطرابات النمو العصبي، Nat. القس نيوروسي. 18 (2017) 658-670.
- طريقة بديلة للجمع بين اللقاحات: الإعطاء داخل الأدمة للمكونات المعزولة للتحكم في الجمرة الخبيثة والتسمم الغذائي والطاعون والصدمة السمية للمكورات العنقودية (نشرت على مجلة العلاجات واللقاحات القائمة على المناعة. 2008 3 سبتمبر ؛ 6: 5. الكتاب Morefield GL، Tammariello RF et al; https://www.ncbi.nlm.nih.gov/pubmed/18768085/)
الشكل (1)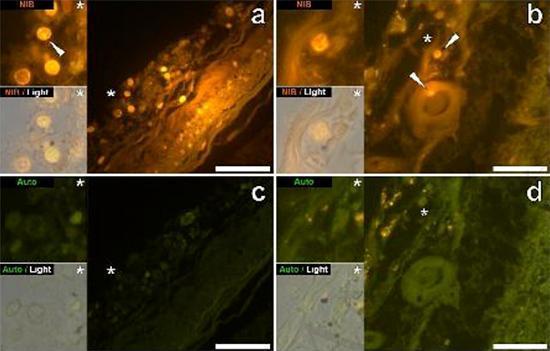
الشكل (2)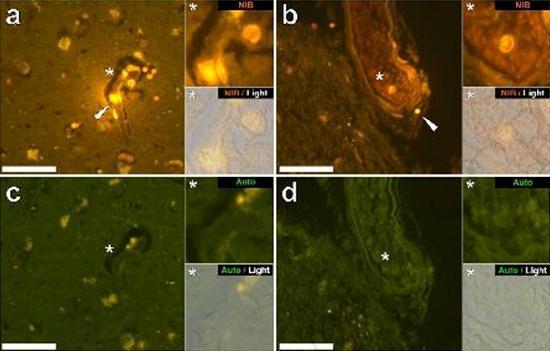
الشكل (3)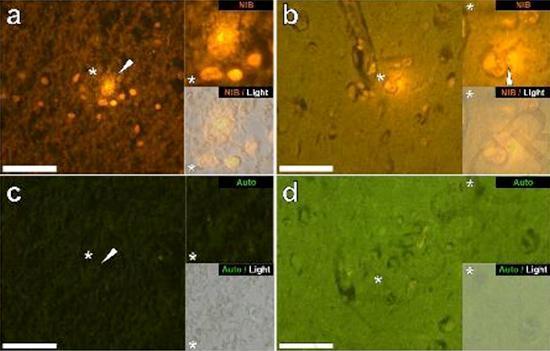
الشكل (4)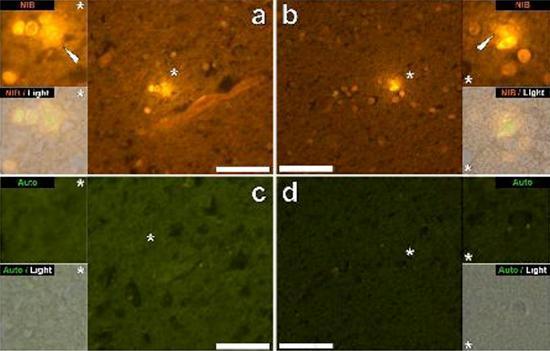
الشكل (5)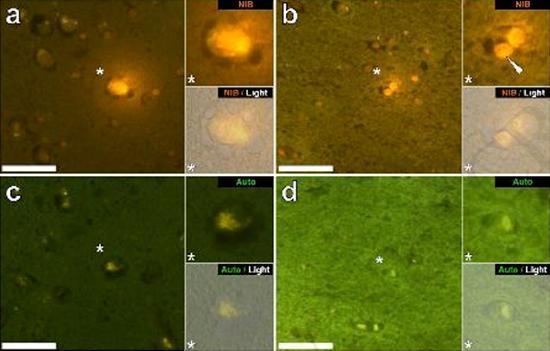
مصدر: الألومنيوم في أنسجة المخ في مرض التوحد
تنزيل: الألومنيوم في أنسجة المخ في مرض التوحد

