Erste Peer-Review-Veröffentlichung zu MPRV-Impfstoffen (Priorix Tetra)

Wir sind endlich da, nach fast zwei Jahren erscheint die erste Veröffentlichung in Peer Review unserer Analysen und viele weitere werden folgen.
Hier versuchen wir auf diesen ersten Seiten sehr diskursiv und nicht technisch zusammenzufassen: Was wurde veröffentlicht, welche Gültigkeit hat es und warum ist es wichtig für unsere Untersuchung von Impfstoffen.
(Andererseits sind die Seiten 3 bis XNUMX einer technischen Studie gewidmet, wobei die Bewertung des Artikels selbst den in diesem Sektor tätigen Personen überlassen bleibt.)
Was auf "F1000 Research" veröffentlicht wurde 1 Es ist das Ergebnis des ersten Teils der Arbeiten, die im Auftrag der Corvelva Association von einem der für die Analysen zuständigen Laboratorien durchgeführt wurden. Erinnern Sie sich - weil seit Beginn dieser Arbeit mehr als zwei Jahre vergangen sind und viele andere Ergebnisse zu den ersten hinzugefügt wurden -, dass die Das erste große Problem, das wir untersuchen mussten, war die abnormale Menge an menschlicher DNA, die in den analysierten Impfstoffen gefunden wurde.
In beiden analysierten vierwertigen MPRV-Impfstoffen wurden anfänglich Mengen von 1 bis 2,7 Mikrogramm / Fläschchen gefunden (gemäß der fraglichen Veröffentlichung), und dies führte dazu, dass wir dieses Ergebnis öffentlich und sofort berichteten, da einfach nicht erwartet wurde, dass a Diese Menge an DNA war in einem Impfstoff vorhanden.
Abgesehen von den Überlegungen und Schlussfolgerungen, zu denen die Arbeit gelangt, die streng technisch und daher nur für diejenigen verständlich sind, die auf dem Gebiet der Metagenomik forschen, wird in den Grafiken festgestellt, dass die beiden Impfstoffproben einen hohen Prozentsatz von enthalten Ablesungen von menschlicher DNA zusätzlich zu den vom Genom des Windpockenvirus (Human Alphaherpes Virus 3) erwarteten Ablesungen, nur nachweisbar von den vier, als eine DNA-seq-Analyse in dem Artikel vorgestellt wurde.
Wir möchten jedoch betonen, dass später die DNA-Mengen damit gefunden und bestätigt werden Methode, die jetzt hier validiert wird waren sogar noch höher: bis zu 3,7 Mikrogramm pro Fläschchen, was zu einem signifikanten Unterschied zwischen Charge und Charge führte.
In unserem Bericht vom 22.12.2018 2 Ergebnisse wurden für gemeldet Weitere Lose wurden nach den im Artikel diskutierten analysiert, dann weiter bestätigt durch Ringversuchsanalysen, die noch veröffentlicht werden.
Was uns an dieser Veröffentlichung am meisten interessiert, ist daher, dass sie die verwendete Methode validiert, legt einen wichtigen Punkt auf die Diskussionen über die "Art" der durchgeführten Analysen und folglich bestätigt maßgeblich alle später mit der NGS-Methode geleisteten Arbeiten: die Erkenntnisse über die Art des enthaltenen genetischen Materials, das Vorhandensein von zufälligen Viren, das große Fehlen abgeschwächter Viren, die stattdessen vorhanden sein sollten, und die Menge der vorhandenen menschlichen DNA, der mutierten Population, außer Kontrolle (auch weil sie von Probe zu Probe sehr unterschiedlich ist) , Phagen, DNA von anderen Arten und nach und nach alle Ergebnisse, die Sie auf unserer Website finden. 3
Alles, was wir in Bezug auf den biologischen Inhalt in den letzten Jahren denunziert haben und die Ergebnisse sklavisch an die Kontrollstellen gemeldet haben, nimmt eine relevantere wissenschaftliche Konnotation an (auch wenn wir es noch einmal wiederholen, waren es nicht die Peer-Reviews, die sich Sorgen machen mussten Die vorgelegten Daten sind jedoch inhaltlich und in ihren möglichen Auswirkungen auf die menschliche Gesundheit sehr ernst. Nachdem die Methode veröffentlicht wurde, werden wir jedoch verlangen, die Antworten zu erhalten, die noch nicht eingetroffen sind.
Diese Ergebnisse bestätigen schlüssig das Vorhandensein von fötaler DNA in Priorix-Tetra-Impfstoffen in Mengen, die zwischen den verschiedenen Chargen variieren, was auf eine schlechte Qualitätskontrolle dieser pharmazeutischen Produkte hinweist.
Wir erinnern uns auch an den Bericht über die Sequenzierung des gesamten MRC-5-Genoms, der am 27.09.2019 auf der Corvelva-Website veröffentlicht wurde 4 wobei die tiefgreifende Modifikation dieser DNA auch in Genen offensichtlich ist, die mit der Entwicklung von Tumorpathologien assoziiert sind (andere Daten werden veröffentlicht).
Die kontaminierende fötale DNA, die in allen in variablen Mengen analysierten Proben vorhanden ist (daher unkontrolliert), ist bis zu 300-mal höher als der von der EMA festgelegte Grenzwert für krebserzeugende DNA (10 ng / Dosis, entsprechend der in etwa 1000 Krebszellen enthaltenen DNA). auf der Grundlage einer statistischen Berechnung erhalten, während die Vorsichtsgrenze 100 pg / Dosis beträgt), die notwendigerweise auch auf die fötale DNA angewendet werden muss, die den Priorix Tetra unvermeidlich kontaminiert.
Daraus folgt, dass dieser Impfstoff als mangelhaft und potenziell gefährlich für die menschliche Gesundheit angesehen werden muss, insbesondere für die pädiatrische Bevölkerung, die aufgrund der Unreife in den Schutzsystemen viel anfälliger für genetische Schäden und Autoimmunschäden ist.
Wie erwartet ist das Folgende für Laien "technischer" und schwer zu verstehen, daher haben wir uns aus Gründen der Transparenz entschlossen, diesem Dokument auch das beizufügen "EMA - NGS Dossier Diskussion der Ergebnisse der Umfrage zur Impfstoffqualität". Wir mussten nur den offengelegten Teil extrapolieren, mehr als 50 Seiten Dossiers im Vergleich zu den 200 Seiten des NGS, da ein Großteil der bei den Aufsichtsbehörden enthaltenen und registrierten Informationen vertraulich bleiben muss. Das strenge Wissenschaftsgesetz verlangt, dass Daten nur dann in einer Zeitschrift veröffentlicht werden, wenn sie nicht veröffentlicht wurden, und wir, da mehrere andere Veröffentlichungen in Bearbeitung sind, wollen sie nicht gefährden.
Um Missverständnisse zu vermeiden, möchten wir ab der Veröffentlichung den Teil der "Finanzierungserklärung" erwähnen:
„Die metagenomische Sequenzierung B1 und B2 wurde von Corvelva (gemeinnütziger Verein, Venetien, Italien) im Rahmen eines Servicevertrags mit dem Labor finanziert. An der Unterstützung der Arbeit waren keine weiteren Beiträge beteiligt. Die Geldgeber hatten keine Rolle beim Studiendesign, bei der Sammlung und Analyse der Daten, bei der Entscheidung zur Veröffentlichung oder bei der Erstellung des Manuskripts. "
Anhänge:
- Veröffentlichung - Versteckst du mich? Auswirkung der Deckungsreduzierung auf Sequenzierungsstudien mit Metagenom-Schrotflinten
- CORVELVA-thread-NGS-EMA-ita
- PDF - Erste Peer-Review-Veröffentlichung zu MPRV-Impfstoffen (Priorix Tetra)
In dem Artikel „Liebst du mich? Auswirkung der Verringerung der Abdeckung auf Sequenzierungsstudien mit Metagenom-Schrotflinten "
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
Die Autoren befassen sich mit der technisch-methodischen Frage, ob es möglich ist, einen massiven parallelen Metagenomik-Ansatz mit geringer Leseabdeckung zur Charakterisierung komplexer biologischer Matrizen zu verwenden. Schätzungen der Diversität, des Artenreichtums und der Fähigkeit, das De-novo-Metagenom in Bezug auf Länge und Vollständigkeit zu rekonstruieren, werden berechnet, um zu verstehen, wie stark die Abnahme der Sequenzierungstiefe, die durch zufällige Unterabtastung der Sequenzierungsablesungen variiert wird, möglich ist Die Ergebnisse zeigen, dass die Diversitätsindizes von prokaryotischen, eukaryotischen und viralen Komplexgemeinschaften mit 500.000 Lesevorgängen oder weniger genau geschätzt werden können, obwohl für besonders komplexe Proben möglicherweise 1.000.000 Lesevorgänge erforderlich sind. Umgekehrt erfordert ein Projekt zur Rekonstruktion des Metagenoms und der darin enthaltenen Gene eine Anzahl von mehr als 1.000.000 Lesevorgängen.
Unter den verschiedenen und sehr unterschiedlichen komplexen Matrices, die einer massiven metagenomischen Analyse unterzogen wurden, wurden zwei biologische Arzneimittel eingeschlossen, dh zwei verschiedene Chargen abgeschwächter MPRV-Lebendimpfstoffe, die zur Immunisierung gegen Masern, Mumps, Röteln und Windpocken bei Kindern verwendet wurden. DNA wurde aus den Impfstoffen extrahiert, genomische Bibliotheken wurden dann unter Verwendung kommerzieller Standardprotokolle aufgebaut und eine massive Sequenzierung mit der Illumina-Technologie wurde durchgeführt.
Abgesehen von den Überlegungen und Schlussfolgerungen, zu denen die Arbeit gelangt, die streng technisch und daher nur für diejenigen verständlich sind, die auf dem Gebiet der Metagenomik forschen, wird in den Kreisdiagrammen in den „erweiterten Daten“ (https://osf.io/wq395/ Bei den Proben B1 und B2 wurde festgestellt, dass die beiden Impfstoffproben zusätzlich zu denjenigen, die vom Genom des Varizellenvirus (Humanes Alphaherpes-Virus 3) erwartet werden, einen hohen Prozentsatz an menschlichen DNA-Messwerten enthalten Eine DNA-seq-Typ-Analyse wurde vorgestellt.
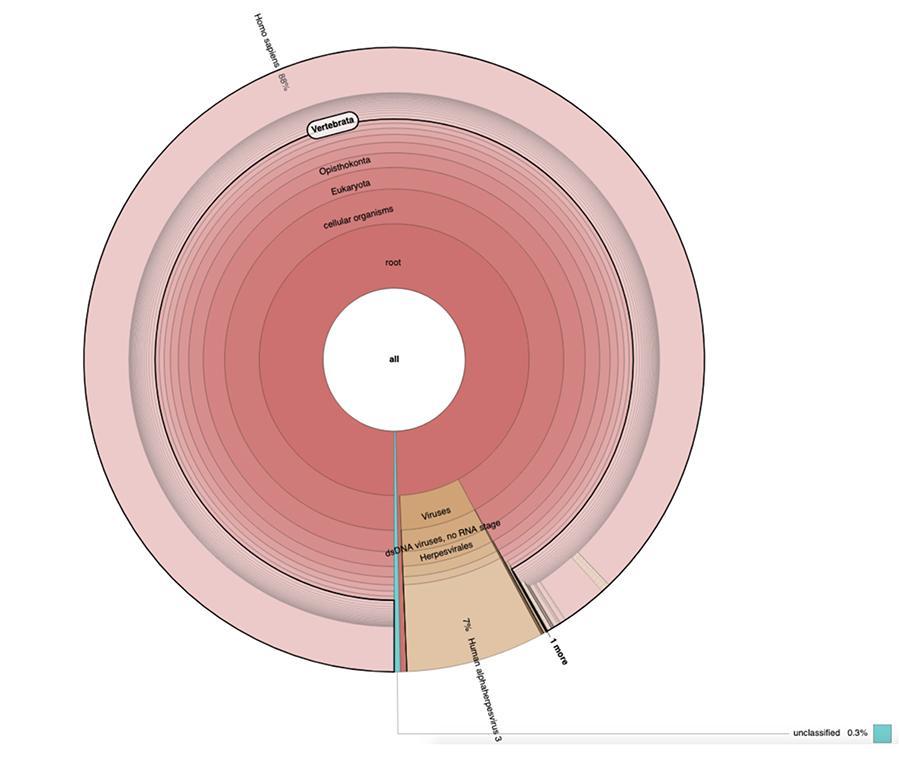
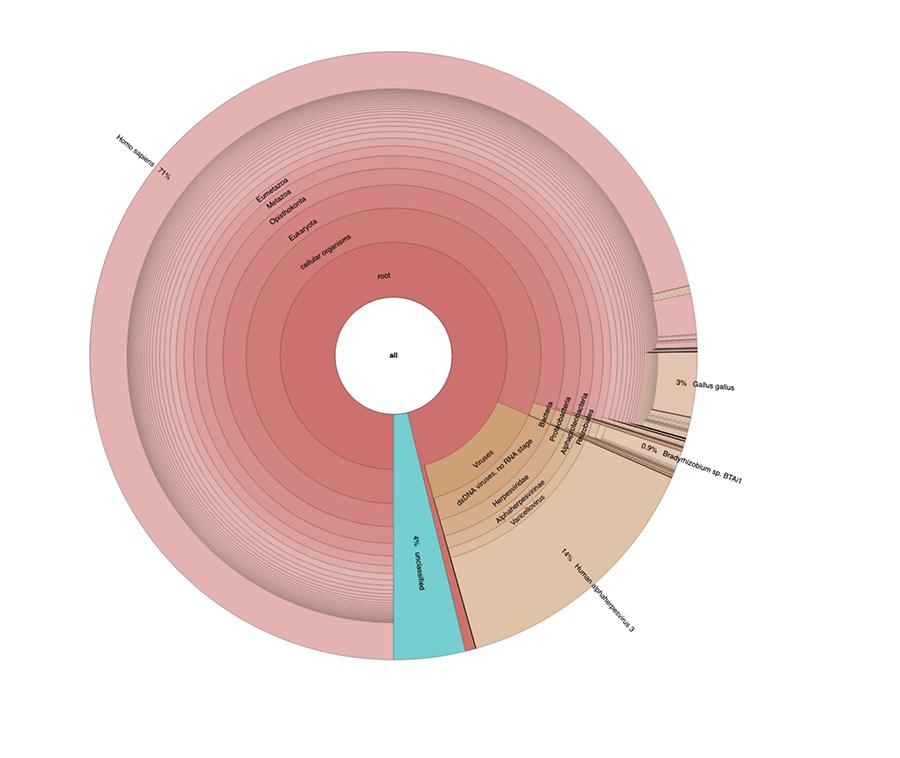
71% der Messwerte in einer Charge und 88% in der anderen sind menschlichen Ursprungs und stammen vermutlich aus der Zelllinie fötalen Ursprungs MRC-5 (Denken Sie daran, dass nachfolgende Analysen bestätigt haben, dass die Linie MRC5 ist) in denen lebende abgeschwächte Röteln- und Windpockenviren während der Impfstoffzubereitung gezüchtet werden. Wie in den verschiedenen Chargen desselben von Corvelva zwischen 2017 und 2019 getesteten MPRV-Impfstoffs liegt die Menge der extrahierten DNA in der Größenordnung des Mikrogramms.
In den Impfchargen, die mit denselben Protokollen und Technologien getestet wurden, die in den Materialien und Methoden des Artikels angegeben sind, lagen die nachgewiesenen Mengen zwischen 1 und fast 3 Mikrogramm pro Fläschchen, wobei die Mengen zwischen einer Charge und einer anderen variierten, aber immer signifikant waren
In dem von Corvelva am 22.12.2018 veröffentlichten Bericht wurden die folgenden Ergebnisse für gemeldet Weitere Lose wurden nach den im Artikel diskutierten analysiert, dann weiter bestätigt durch noch veröffentlichte Ringversuchsanalyse:
Priorix Tetra viel. A71CB205A (Juni 2018) - DNA-Analyse
Priorix Tetra viel. A71CB256A (Dezember 2018) - DNA-Analyse
DNA-Analyse
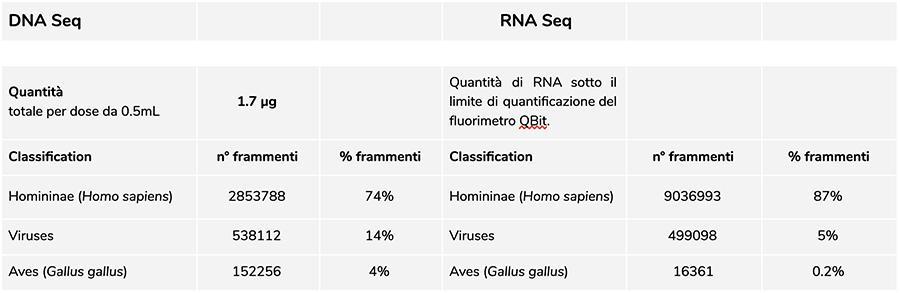
Die Messung der Konzentration von DNA mit QuBit zeigte Fluorimeter, dass Charge A71CB205A eine Menge von enthält 1.7 ug gDNA Gesamtmenge pro 0.5 ml Dosis, berechnet wie folgt: 9.41 ng / µl (Konzentration bestimmt bei QuBit) x 45 (endgültiges Resuspensionsvolumen der DNA nach Extraktion, ausgedrückt in Mikrolitern) x 4 (das dem Extraktionsverfahren unterworfene Ausgangsvolumen beträgt ¼ das Volumen der in der gesamten Durchstechflasche enthaltenen Dosis beträgt 0.5 ml).
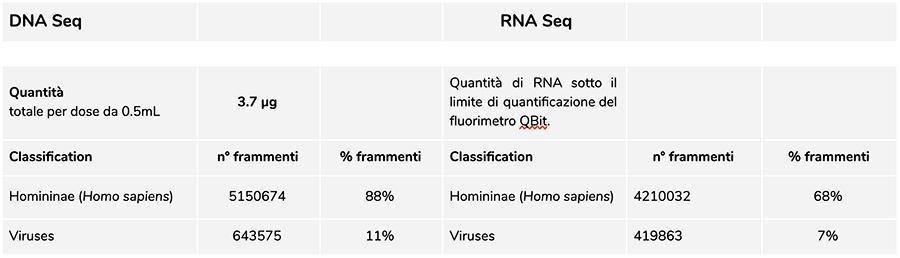
Die Messung der Konzentration von DNA mit QuBit zeigte Fluorimeter, dass Charge A71CB256A eine Menge von enthält gDNA von insgesamt 3.7 µg pro 0.5 ml Dosis, berechnet wie folgt: 40.8 ng / ul (Konzentration bestimmt bei QuBit) x 55 (endgültiges Resuspensionsvolumen der DNA nach Extraktion, ausgedrückt in Mikrolitern) x 5/3 (das dem Extraktionsverfahren unterworfene Ausgangsvolumen beträgt 300 ul von 500) µl Suspension).
Die in dieser Charge gefundene menschliche DNA hat ein relatives Verhältnis von etwa 8 zu 1 im Vergleich zur Windpocken-DNA (siehe folgende Ergebnisse der Klassifizierung der DNA-seq-Fragmente, bei denen sich herausstellt, dass 88% der Gesamtmenge der sequenzierten DNA-Fragmente von sind menschlicher Ursprung und 11% stammen aus dem Genom des Varizellenvirus). In Anbetracht der Tatsache, dass das NGS eine quantitative Technologie ist, ermöglicht uns die fluorimetrische Quantifizierung der aus dem Impfstoff extrahierten Gesamt-DNA (z. B. Charge A71CB256A = 3,7 Mikrogramm pro Dosis), verbunden mit der Berücksichtigung der oben vorgenommenen relativen Quantifizierung (8: 1) zu sagen, dass menschliche DNA in der Nähe sein könnte 2,9 Mikrogramm pro Dosisim Vergleich zu etwa 740 Nanogramm Windpocken-DNA. Es ist auch plausibel, dass Mindestens ein Teil der DNA mit hohem Molekulargewicht, die auf dem Gel zu sehen ist, kann menschliche DNA mit hohem Molekulargewicht sein.
RNA-Analyse
La Menge RNA Es wurde gefunden, dass das in der Durchstechflasche der Impfstoffcharge A71CB256A enthaltene ungefähr ist 200ng.
Die RIN von 8 zeigt eine RNA von ausgezeichneter Qualität und eine intakte eukaryotische RNA an, da sowohl die für eukaryotische RNA typischen 18S- als auch 28S-Peaks vorhanden sind.
Die Antworten auf unsere Fragen, die im Laufe der Zeit an die Aufsichtsbehörden weitergeleitet werden, sind von großer Bedeutung. Derzeit haben die Agenturen die Fragen zu den Ergebnissen der vollständigen Analysen, die an die EMA und die AIFA übermittelt wurden, noch nicht beantwortet.
Auszug aus der ema-Antwort auf unsere Frage zur Sicherheit von mrc-5-Rückständen im Priorix-Tetra-Impfstoff (EMA-Antragsreferenz ask-43967, 3. August 2018) - „Basierend auf den veröffentlichten Informationen enthält Priorix Tetra Virusstämme, die separat in Hühnerembryozellen (Mumps und Masern) oder in humanen diploiden Zellen MRC-5 (Röteln und Windpocken) produziert werden. Die für Priorix Tetra verwendeten Zelllinien umfassen humane diploide Zelllinien, die sich nicht kontinuierlich teilen können. Es ist zu beachten, dass gemäß dem Europäischen Arzneibuch diploide MRC-5-Zelllinien nicht tumorigen sind, wie durch jahrzehntelange Verwendung und Kontrolle gezeigt wurde, und daher eine Höchstgrenze für die DNA von MRC-5-Zellen nicht gilt. "
Bisher wurden keine Nachweise (weder in Bezug auf Analysezertifikate zur Qualität des Produkts noch in Bezug auf wissenschaftliche Referenzliteratur für die EMA) für diese Kontrollen erbracht, die garantieren, dass es angemessen ist, keine Höchstgrenze anzuwenden.
In der FDA-Richtlinie "Leitfaden für die Industrie: Charakterisierung und Qualifizierung von Zellsubstraten und anderen biologischen Materialien, die bei der Herstellung von Virusimpfstoffen für Indikationen für Infektionskrankheiten verwendet werden" 6 Es wird berichtet, dass:
- Ein Stamm diploider Zellen sollte immer diploid bleiben. Wenn diese Eigenschaften nicht stabil sind, muss nachgewiesen werden, dass die Instabilität die Produktion oder Konformität des Produkts nicht beeinträchtigt.
- Für weit verbreitete humane diploide Zellstämme wie MRC-5- und WI-38-Zellen ist die Messung der restlichen DNA möglicherweise nicht erforderlich, da wir die restliche DNA dieser humanen diploiden Zellen nicht als Sicherheitsbedenken betrachten
- Die restliche DNA sollte für nicht-tumorigene kontinuierliche Zellen, wie z. B. Tiefpass-VERO-Zellen, auf weniger als 10 ng / Dosis für die parenterale Inokulation begrenzt werden, wie von der WHO empfohlen
Und in der WHO-Richtlinie „Anhang 3 - Empfehlungen zur Bewertung tierischer Zellkulturen als Substrate für die Herstellung biologischer Arzneimittel und zur Charakterisierung von Zellbanken. Ersetzung von Anhang 1 der WHO-Reihe technischer Berichte, n. 878 " 7 Wir fügen hinzu: (...) Seit den 38er Jahren wurden beträchtliche Erfahrungen mit der Zytogenetik von WI-5 und MRC-60 gesammelt
und um diese Erfahrung zu unterstützen, werden die folgenden Artikel aufgelistet:
- Jacobs JP. Aktualisierte Ergebnisse zur Karyologie der WI-38-, MRC-5- und MRC-9-Zellstämme. Developments in Biological Standardization, 1976, 37: 155–156.
- Jacobs JP. et al. Richtlinien für die Akzeptanz, Verwaltung und Prüfung von seriell vermehrten humanen diploiden Zellen zur Herstellung von Lebendvirus-Impfstoffen zur Verwendung beim Menschen. Journal of Biological Standardization, 1981, 9: 331–342.
- Petricciani JC et al. Karyologische Standards für die diploide Rhesuszelllinie DBS-FRhL-2. Journal of Biological Standardization, 1976, 4: 43–49.
- Schollmayer et al. Hochauflösende Analyse und differentielle Kondensation in menschlichen Chromosomen mit RBA-Banden. Human Genetics, 1981, 59: 187–193.
- Rønne M. Chromosomenpräparation und hochauflösende Banding-Techniken: eine Übersicht. Journal of Dairy Science, 1989, 72: 1363–1377.
Es kann deutlich beobachtet werden, dass die Referenzliteratur, um zu behaupten, dass diploide Zellen, die zur Herstellung von Impfstoffen verwendet werden, unter dem Gesichtspunkt der genetischen Stabilität sicher sind, es ist veraltet. Bereits vor 40 Jahren wurden die ersten genetischen Anomalien gefunden, die für die Sicherheit von Impfstoffen als vernachlässigbar angesehen wurden, und nach den Angaben in der WHO-Richtlinie wurden seitdem keine Aktualisierungen der neuen Sequenzierungstechnologien vorgenommen, insbesondere bei NGS, was darüber hinaus wirtschaftlich ist und schnell, mit der Folge, dass in den Impfstoffen verabreicht Seit Jahrzehnten wird das Vorhandensein von zunehmend progressiv gentechnisch veränderter DNA in unkontrollierten Mengen von Agenturen zugelassen. Siehe hierzu den am 5 auf der Corvelva-Website veröffentlichten Bericht über die Sequenzierung des gesamten MRC-27.09.2019-Genoms. 8 wobei die tiefgreifende Modifikation dieser DNA auch in Genen offensichtlich ist, die mit der Entwicklung von Tumorpathologien assoziiert sind. (Daten werden veröffentlicht)
Es wird ein Auszug aus dem Brief von Dr. T. Deisher, Weltexperte für die Verwendung von Stammzellen für therapeutische Zwecke und Gentherapie, berichtet, der die Besorgnis über die Risiken hervorhebt, die mit der Verwendung von mit Rückständen kontaminierten Impfstoffen verbunden sind von menschlichen fetalen Zellen:
Dr. T. DEISHER (Brief an die Herrscher - 8. April 2019) 9 - (...) Die Injektion einer menschlichen fetalen DNA-Kontamination in unsere Kinder birgt das Risiko, zwei bekannte Krankheiten zu verursachen:
- Insertionsmutagenese: menschliche fötale DNA wird in die DNA des Babys eingebaut und verursacht Mutationen. Gentherapie unter Verwendung einer homologen Rekombination kleiner Fragmente hat gezeigt, dass Mengen von nur 1,9 ng / ml DNA-Fragmenten bei 100% der injizierten Mäuse zur Insertion von Stammzellen in das Genom führen. Die Spiegel menschlicher fötaler DNA-Fragmente bei unseren Kindern nach Impfung mit MMR-, VARIVAX- (Windpocken) oder Hepatitis-A-Impfstoffen erreichen Werte über 1,9 ng / ml.
- Autoimmunerkrankung: Die fetale menschliche DNA stimuliert die Reaktion des Immunsystems, um den Körper des Babys anzugreifen.
Unsere Ergebnisse verstärken die experimentellen Beobachtungen von Dr. Deisher und vor allem die Tatsache, dass die kontaminierende fötale DNA, die in allen untersuchten Proben in variablen (daher unkontrollierten) Mengen vorhanden ist, stark ist bis zum 300-fachen der EMA-Grenze für krebserzeugende DNA (10 ng / Dosis, entsprechend der in etwa 1000 Krebszellen enthaltenen DNA, die auf der Grundlage einer statistischen Berechnung erhalten wurde, während die Vorsichtsgrenze 100 pg / Dosis beträgt) Grenze, die notwendigerweise auch auf fötale DNA angewendet werden muss, die den Priorix unvermeidlich kontaminiert Tetra.
Daraus folgt, dass dieser Impfstoff als mangelhaft und potenziell gefährlich für die menschliche Gesundheit angesehen werden muss, insbesondere für die pädiatrische Bevölkerung, die aufgrund der Unreife in den Schutzsystemen viel anfälliger für genetische Schäden und Autoimmunschäden ist.
- https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7059852/
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate.html
https://www.corvelva.it/speciale-corvelva/vaccinegate-en.html - https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/speciale-corvelva/vaccinegate/analisi-metagenomiche-su-priorix-tetra.html
- https://www.federalregister.gov/documents/2010/03/04/2010-4553/guidance-for-industry-characterization-and-qualification-of-cell-substrates-and-other-biological
- https://www.who.int/biologicals/vaccines/TRS_978_Annex_3.pdf
- https://www.corvelva.it/speciale-corvelva/vaccinegate/sequenziamento-del-genoma-completo-di-mrc-5-contenuto-in-priorix-tetra.html
- https://www.corvelva.it/approfondimenti/notizie/mondo/lettera-aperta-ai-legislatori-sul-dna-fetale-nei-vaccini-theresa-deisher.html

