Aluminium w tkance mózgowej osób autystycznych

Czasopismo Pierwiastków Śladowych w Medycynie i Biologii
Autorzy: Matthew Mold, Dorcas Umar, Andrew King, Christopher Exley
Listopada 26 2017
Abstrakcyjny
Zaburzenie ze spektrum autyzmu jest neurologicznym zaburzeniem rozwoju o nieznanej etiologii (przyczynie). Sugeruje się, że przyczyna dotyczy zarówno podatności genetycznej, jak i czynników środowiskowych, które ostatecznie obejmują także toksyny środowiskowe. Podjęto próby powiązania ekspozycji człowieka na środowiskową toksynę glinową z zaburzeniem ze spektrum autyzmu. Tutaj zastosowaliśmy technikę poprzecznie ogrzewana spektrometria absorpcji atomowej w piecu grafitowym (spektrometria absorpcji atomowej z ogrzewanego poprzecznie pieca grafitowego) do pomiaru, po raz pierwszy, zawartości glinu w tkance mózgowej dawców z rozpoznaniem autyzmu. Użyliśmy również selektywnego fluoru dla aluminium do identyfikacji aluminium w tkance mózgowej za pomocą mikroskopii fluorescencyjnej. Zawartość glinu w tkance mózgowej w autyzmie jest zdecydowanie wysoka. Średnia (w nawiasach odchylenie standardowe) zawartości aluminium u 5 osobników dla każdego płata wynosiła 3,82 (5,42), 2,30 (2,00), 2,79 (4,05) i 3,82, 5,17 (15) μg / g suchej masy odpowiednio dla płatów potylicznego, czołowego, skroniowego i ciemieniowego. Są to jedne z najwyższych mierzonych do tej pory wartości glinu w ludzkiej tkance mózgowej i należy się zastanawiać, dlaczego na przykład zawartość glinu w płacie potylicznym 8,74-letniego chłopca powinna wynosić 11,59 (10) μg / g masy suchej masy? Selektywną mikroskopię fluorescencyjną z aluminium zastosowano do identyfikacji aluminium w tkance mózgowej XNUMX dawców. Chociaż wyobrażano sobie, że aluminium jest związane z neuronami, zaobserwowano, że jest ono obecne w strefie wewnątrzkomórkowej w komórkach podobnych do mikrogleju i w innych nieneuronalnych komórkach zapalnych opon mózgowych, unaczynienia, istoty szarej i istoty białej. Ważność wewnątrzkomórkowego aluminium związanego z komórkami nieneuronalnymi stanowi wyjątkową obserwację w tkance mózgowej osób autystycznych i może dostarczyć wskazówek zarówno na temat pochodzenia glinu obecnego w mózgu, jak i możliwej roli tej substancji w wywoływaniu zaburzenia spektrum autystyczne.
wprowadzenie
Zaburzenie ze spektrum autyzmu (ASD) to grupa stanów patologicznych rozwoju neurologicznego o nieznanej przyczynie. Zarówno czynniki genetyczne [1], jak i środowiskowe [2] najprawdopodobniej będą związane z początkiem i postępem ASD, podczas gdy oczekuje się, że mechanizmy leżące u podstaw ASI będą wieloczynnikowe [3-6]. Podejrzewa się, że narażenie człowieka na glin jest przyczyną ASD, ale wnioski są wątpliwe [7–10]. Do tej pory większość badań wykorzystywała włosy jako wskaźnik narażenia człowieka na glin, podczas gdy zawartość aluminium we krwi i moczu była wykorzystywana w znacznie bardziej ograniczonym zakresie. Szczepionki pediatryczne zawierające adiuwant na bazie glinu są pośrednią miarą narażenia niemowląt na glin, a ich zwiększone stosowanie było bezpośrednio związane ze zwiększoną częstością występowania ASD [11]. Modele zwierzęce ASD nadal wspierają połączenie z aluminium i adiuwantami na bazie aluminium stosowanymi szczególnie do szczepień u ludzi [12]. Do chwili obecnej nie ma badań dotyczących obecności aluminium w tkance mózgowej dawców, którzy zmarli z rozpoznaniem ASD. Zmierzyliśmy ilość aluminium obecnego w tkance mózgowej osób autystycznych i zidentyfikowaliśmy lokalizację aluminium w tych tkankach.
Materiały i metody
2.1. Pomiar ilości glinu w tkankach mózgu
Zatwierdzenie etyczne uzyskano wraz z chusteczkami z „Oxford Brain Bank” (Oxford Brain Bank - 15 / SC / 0639). Próbki kory równe około 0,3 gramowi zamrożonej materii płatów skroniowych, czołowych, ciemieniowych i potylicznych oraz hipokampa (tylko 5 gr) uzyskano od 4 osób z rozpoznaniem ASD potwierdzonym przez ADI-Rconfirmed (Autism Diagnostic Interview -Revised), 1 mężczyzn i 15 kobieta, w wieku od 50 do 1 lat (Tabela 13). Zawartość aluminium w tych tkaninach została zmierzona za pomocą skonsolidowanej iw pełni zwalidowanej metody [XNUMX], która jest tu jedynie krótko opisana.
wyniki
3.1 Zawartość glinu w tkankach mózgu
Zawartość glinu we wszystkich tkankach wahała się od 0,01 (granica oznaczalności) do 22,11 mg / g masy suchej masy. (Tabela 1). Zawartość glinu w mózgu jako całości (n = 4 lub 5 w zależności od dostępności tkanki hipokampu) wahała się od 1,20 (1,06) mg / g suchej masy dla 44-letniej kobiety (A1 ) do 4,77 (4,79) mg / g 33-letniego mężczyzny (A5). Wcześniejsze pomiary glinu w mózgu, w tym nasze badanie 60 mózgów [15], pozwoliły nam z grubsza zdefiniować klasy zawartości glinu, zaczynając od wartości mniejszych lub równych 1,00 mg / g jako patologicznie łagodne (odwrotnie pojęcia „normalności”). Około 40% tkanek (24/59) miało zawartość glinu uważaną za patologicznie niepokojącą (³2,00 mg / g), podczas gdy około 67% tych tkanek miało zawartość glinu uznawaną za istotną patologicznie (³3,00 mg / g ). Mózgi wszystkich 5 osób mają co najmniej jedną tkankę z patologicznie znaczącą zawartością glinu. Mózgi 4 osób miały co najmniej jedną tkankę z zawartością glinu większą lub równą 5,00 mg / g, podczas gdy 3 z nich miało co najmniej jedną tkankę o zawartości glinu większej lub równej 10,00 mg / g (Tabela 1). Średnia zawartość glinu (odchylenie standardowe w nawiasach) dla 5 osobników dla każdego płata wynosiła 3,82 (5,42), 2,30 (2,00), 2,79 (4,05) i 3,82 ( 5,17) dla płatów czołowych, potylicznych, czołowych, skroniowych i ciemieniowych. Nie było statystycznie istotnych różnic w zawartości glinu między 4 płatami.
3.2. Fluorescencja dzięki glinowi w tkankach mózgu
Przebadaliśmy szereg skrawków mózgu 10 osób (3 kobiety i 7 mężczyzn), którzy zmarli z rozpoznaniem ASD, i odnotowaliśmy obecność glinu w tych tkankach (Tabela S1). Podniecenie kompleksu glinu i lumogalionu emituje charakterystyczną pomarańczową fluorescencję, która wydaje się coraz bardziej jasnożółta wraz ze wzrostem intensywności fluorescencji. Aluminium, zidentyfikowane jako reaktywne złoża lumogalionu, zarejestrowano w co najmniej jednej tkance u wszystkich 10 osób. Autofluorescencja bezpośrednio przyległych odcinków seryjnych potwierdziła, że fluorescencja lumogalionu wskazuje na obecność glinu. Złogi glinu występowały znacznie częściej u mężczyzn (129 na 7 osób) niż u kobiet (21 na 3 osoby). Aluminium znaleziono zarówno w materii białej (62 złoża), jak i szarej (88 złóż). U kobiet większość złóż glinu zidentyfikowano jako pozakomórkowe (15 z 21), podczas gdy u mężczyzn stwierdzono odwrotną sytuację z 80 ze 129 złogów w obszarze wewnątrzkomórkowym. Dostarczono nam tylko 3 seryjne odcinki każdej tkanki i dlatego nie byliśmy w stanie wykonać żadnego barwienia mającego na celu identyfikację ogólnej morfologii, co oznacza, że nie zawsze było możliwe określenie, który podtyp komórki wykazywał fluorescencję z powodu glinu , Białe jednojądrzaste komórki krwi obciążone glinem, prawdopodobnie limfocyty, zostały zidentyfikowane w oponach i prawdopodobnie wchodziły do tkanki mózgowej z układu limfatycznego (ryc. 10). Aluminium można wyraźnie zobaczyć w komórkach lub w postaci dyskretnych złóż punktowych lub jako intensywne żółte fluorescencje (ryc. 1). Aluminium zlokalizowano w komórkach zapalnych związanych z unaczynieniem (ryc. 2). W jednym przypadku coś, co wydaje się być limfocytem lub monocytem obciążonym aluminium, odnotowano w naczyniu krwionośnym otoczonym czerwonymi krwinkami, podczas gdy inny prawdopodobny limfocyt wykazujący intensywną żółtą fluorescencję odnotowano w błonie przypadkowej (ryc. 2b). Komórki glejowe, w tym niektóre podobne do mikrogleju, które wykazywały fluorescencję z powodu obecności glinu, często obserwowano w tkance mózgowej w pobliżu złóż pozakomórkowych zabarwionych aluminium (ryc. 3 i 4). Osady glinu o średnicy około 1 mm były wyraźnie widoczne zarówno w okrągłych, jak i ameboidalnych ciałach komórek glejowych (np. Rys.. 3b). Wewnątrzkomórkowe aluminium zostało zidentyfikowane w prawdopodobnych neuronach i komórkach podobnych do tych w glejach i często w pobliżu lub w tym samym miejscu co lipofuscyna (ryc. 5). Selektywna fluorescencja glinu działała w identyfikacji aluminium w miejscach pozakomórkowych i wewnątrzkomórkowych w komórkach neuronalnych i nieneuronalnych oraz we wszystkich badanych tkankach mózgu (ryc. 1-5). Metoda identyfikuje aluminium tylko na podstawie dużych obszarów tkanki mózgowej bez żadnej charakterystycznej fluorescencji wskazującej na dodatni poziom aluminium (ryc.
Discussione
Zawartość glinu w tkance mózgowej dawców ze zdiagnozowanym ASD była niezwykle wysoka (tab. 1). Chociaż stwierdzono znaczną zmienność między różnymi tkankami, różnymi płatami i różnymi podmiotami, średnia zawartość glinu dla każdego płata (wśród 5 osobników) była na najwyższym poziomie wszystkich poprzednich pomiarów zawartości glinu w mózgu, w tym przypadki zaburzeń jatrogennych, takich jak encefalopatia dializacyjna [13,15, 16-19]. Wszyscy 4 dawcy płci męskiej mieli wyższe stężenia glinu w mózgu niż jedyny dawca płci żeńskiej. U tych autystycznych samców odnotowaliśmy jedne z najwyższych wartości zawartości glinu w mózgu, jakie kiedykolwiek mierzono w zdrowych lub chorych tkankach, w tym wartości 17,10 18,57 i 22,11 mg / g suchej masy. (Tabela 1). Tym, co odróżnia te dane od innych analiz glinu w mózgu w innych chorobach, jest wiek osób z autyzmem. Dlaczego, na przykład, 15-letni chłopiec miałby tak wysoką zawartość glinu w swojej tkance mózgowej? W literaturze naukowej brak jest porównywalnych danych, najbliższe podobnie wysokie dane dotyczą 42-letniego mężczyzny z „rodzinną postacią” choroby Alzheimera (FAD) [19]. Selektywna mikroskopia fluorescencyjna glinu dostarczyła wskazań miejsc odkładania glinu w tych tkankach mózgowych osób z autyzmem (ryciny 1-5).
Aluminium znaleziono zarówno w materii białej, jak i szarej oraz w miejscach zewnątrzkomórkowych i komórkowych. Te ostatnie były szczególnie rozpowszechnione w tkankach osób z autyzmem. Komórki, które morfologicznie okazały się nieneuronalne i mocno obciążone aluminium, zidentyfikowano jako komórki związane z oponami mózgowymi (ryc. 1), waskularyzacją (ryc. 2) oraz jako komórki istoty szarej i istoty białej (ryciny 3-5). Niektóre z tych komórek wyglądały na glejowe (prawdopodobnie astrocyty), podczas gdy inne miały wydłużone jądra, które nadawały im wygląd komórek mikrogleju [5]. Te ostatnie czasami obserwowano w pobliżu pozakomórkowych złóż glinu. Oznacza to, że aluminium w jakiś sposób przekroczyło barierę krew-mózg i zostało pobrane z natywnej komórki, komórki mikrogleju. Co ciekawe, sporadyczna obecność komórek zapalnych obciążonych glinem w unaczynieniu i leptomeningach otwiera możliwość innego sposobu wprowadzania aluminium do mózgu lub wewnątrzkomórkowo. Jednak, aby ten drugi scenariusz był ważny, można by oczekiwać, że wystąpi pewien rodzaj uszkodzenia śródmózgowego, który umożliwi ucieczkę limfocytów i monocytów z unaczynienia. Dokonana tutaj identyfikacja nieneuronalnych komórek, w tym komórek zapalnych, komórek glejowych i komórek mikrogleju, wszystkie obciążonych glinem, jest wyjątkową obserwacją dla ASD. Na przykład większość złóż glinu zidentyfikowanych w tkance mózgowej w „znanych postaciach” choroby Alzheimera była pozakomórkowa i prawie zawsze związana z materią szarą [19].
Glin jest cytotoksyczny [21], a jego powiązanie (pokazane tutaj) z komórkami zapalnymi unaczynienia, opon mózgowych i ośrodkowego układu nerwowego nie może być łagodne. Mocno obciążona mikrogleju glinu, chociaż może pozostać opłacalna, przynajmniej przez pewien czas, nieuchronnie zostanie zagrożona, a uważa się, że dysfunkcja mikrogleju jest zaangażowana w etiologię ASD [22], na przykład w niszczenie synaptycznej bezlistności [23] , Ponadto fakt, że dane te sugerują, że wejście glinu do mózgu przez komórki układu odpornościowego krążące we krwi i limfie u osób autystycznych może zacząć wyjaśniać postawione pytanie, po pierwsze, dlaczego w mózgu 15-letniego autystycznego chłopca jest tyle aluminium. Ograniczeniem naszego badania jest niewielka liczba przypadków dostępnych do analizy i ograniczona dostępność tkanek. Jeśli chodzi o ten ostatni czynnik, dostęp do tylko 1 g zamrożonej tkanki i tylko 3 seryjne odcinki tkanki przymocowane do płata można normalnie uznać za znaczące ograniczenie. Z pewnością, gdybyśmy nie zidentyfikowali żadnego znaczącego złoża glinu w tak małej próbce tkanki (średnia masa mózgu waha się między 1.500 a 2.000 g), wówczas taki wynik byłby niejednoznaczny. Jednak fakt, że znaleźliśmy aluminium w każdej pojedynczej próbce tkanki, zamrożonej lub zamrożonej, zdecydowanie sugeruje, że osoby ze zdiagnozowanym ASD mają wyjątkowo wysoki poziom glinu w tkance mózgowej i że to aluminium jest przede wszystkim związane z zawartymi komórkami nieneuronalnymi mikrogleju i innych zapalnych monocytów.
wnioski
Pierwszy pomiar zawartości glinu w tkance mózgowej wykonaliśmy u osób autystycznych i wykazaliśmy, że zawartość glinu w mózgu jest wyjątkowo wysoka. Zidentyfikowaliśmy aluminium w tkance mózgowej zarówno w obszarach zewnątrzkomórkowych, jak i wewnątrzkomórkowych (zarówno w neuronach, jak i komórkach nieneuronalnych). Obecność glinu w komórkach zapalnych w oponach mózgowych, w unaczynieniu, w istocie szarej i białej jest wyjątkową obserwacją i może wykazać przyczynę roli aluminium w etiologii ASD.
PSUR 16: podwojenie oczekiwanych zgonów
Jeśli wszystkie dzieci, które otrzymały pierwszą dawkę szczepionki, otrzymały łącznie cztery dawki, a ostatnia dawka została podana w drugim roku życia, wówczas można oszacować, że jedna czwarta (25%) dawek jest podawana starszym dzieciom do roku. Jest to zalecany harmonogram szczepień w Niemczech. Jednak niektóre kraje, takie jak Włochy, zalecają tylko trzy dawki, wszystkie w pierwszym roku i żadne w drugim. Ponadto nie wszystkie dzieci otrzymują wszystkie zalecane dawki. Tak więc prawdopodobnie nie będzie 20-25% dawek w drugim roku. W raporcie PSUR 15 oszacowano, że 90,6% sprzedawanych dawek stosowano u niemowląt w wieku poniżej jednego roku i 9,4% w przypadku dzieci w wieku powyżej jednego roku. W raporcie PSUR 16 szacunkowe dawki otrzymane w drugim roku wzrosły ponad dwukrotnie (z 9,4% do 20%), a zatem szacowana liczba zgonów podwoiła się. Pomimo podwojenia oczekiwanych zgonów liczba zgonów zaobserwowanych w drugim roku była wyższa niż oczekiwano w pierwszych 3 dniach po szczepieniu (Tabela 36, str. 249). Jeżeli oszacowanie w PSUR 15, że 9,4% dawek zostanie zastosowane w drugim roku, jest prawidłowe, dotyczy to również PSUR 16, a zatem zaobserwowane zgony są wyższe niż spodziewane zgony w ciągu pierwszych 7 dni.
Konflikty interesów
Autorzy deklarują, że nie mają konfliktu interesów
podziękowanie
Badania są wspierane ze środków finansowych z Dziecięcy Instytut Badań nad Bezpieczeństwem Medycznym (CMSRI), fundacja non-profit z siedzibą w Waszyngtonie, USA, która zajmuje się badaniami
Referencje
- A. Krishnan, R.Zhang, V. Yao, CL Theesfeld, AK Wong i wsp., Prognozowanie całego genomu i funkcjonalna charakterystyka genetycznych podstaw zaburzeń spektrum autyzmu, Nature Neuroscience 19 (2016) 1454-1462.
- LA Sealey, BW Hughes, AN Sriskanda, JR Guest, AD Gibson i wsp., Czynniki środowiskowe w rozwoju zaburzeń ze spektrum autyzmu, Environ. Int. 88 (2016) 288–298.
- R. Koyama, Y. Ikegaya, Microglia w patogenezie zaburzeń ze spektrum autyzmu, Neurosci. Res. 100 (2015) 1-5.
- Q. Li, JM. Zhou, oś mikrobiota-jelito-mózg i jej potencjalna terapeutyczna rola w zaburzeniu ze spektrum autyzmu, Neuroscience 324 (2016) 131-139.
- C. Kaur, G. Rathnasamy, EA. Ling, Biologia mikrogleju w rozwijającym się mózgu, J. Neuropathol Exp. Neurol. 76 (2017) 736–753.
- M. Varghese, N. Keshav, S. Jacot-Descombes, T. Warda, B. Wicinski i wsp., Zaburzenie ze spektrum autyzmu: neuropatologia i modele zwierzęce, Acta Neuropathol. 134 (2017) 537–566.
- H. Yasuda, Y. Yasuda, T. Tsutsui, Szacowanie dzieci autystycznych za pomocą analizy metalomicznej, Sci. Rep. 3 (2013) 1199.
- FEB Mohamed, EA Zaky, AB El-Sayed, RM Elhossieny, SS Zahra i in., Ocena aluminium do włosów, ołowiu i rtęci w próbce egipskich dzieci autystycznych: środowiskowe czynniki ryzyka związane z metalami ciężkimi w autyzmie, Neurol behawioralny. (2015) Art. 545674.
- MH Rahbar, M. Samms-Vaughn, MR Pitcher, J. Bressler, M. Hessabi i wsp., Rola genów metabolicznych we stężeniach glinu we krwi jamajskich dzieci z zaburzeniami ze spektrum autyzmu i bez, Int. J. Environ. Res. Public Health 13 (2016) 1095.
- AV Skalny, NV Simashkova, TP Klyushnik, AR Grabeklis, IV Radysh i wsp., Analiza pierwiastków śladowych włosów u dzieci z zaburzeniami ze spektrum autyzmu i zaburzeniami komunikacji, Trace Elem. Med. Biol. 177 (2017) 215–223.
- L. Tomljenovic, CA Shaw, Czy adiuwanty do szczepionek aluminiowych przyczyniają się do wzrostu rozpowszechnienia autyzmu ?, J. Inorg. Biochem. 105 (2011) 1489–1499.
- CA Shaw, Y. Li, L. Tomljenovic, Podawanie glinu myszom noworodkowym w odpowiednich ilościach szczepionki wiąże się z niekorzystnymi długoterminowymi wynikami neurologicznymi, J. Inorg. Biochem. 128 (2013) 237-244
- E. House, M. Esiri, G. Forster, P. Ince, C. Exley, aluminium, żelazo i miedź w tkankach ludzkiego mózgu przekazane na badania funkcji poznawczych i starzenia się rady badań medycznych, Metallomics 4 (2012) 56-65.
- M. Mold, H. Eriksson, P. Siesjö, A. Darabi, E. Shardlow, C. Exley, Jednoznaczna identyfikacja wewnątrzkomórkowego aluminiowego adiuwanta w monocytowej linii komórkowej THP-1, Sci. Rep. 4 (2014) 6287.
- A. Mirza, A. King, C. Troakes, C. Exley, Identyfikacja glinu w ludzkiej tkance mózgowej za pomocą lumogalionu i mikroskopii fluorescencyjnej, J. Alzh. Dis. 54 (2016) 1333–1338.
- C. Exley, M. Esiri, Ciężka mózgowa angiopatia congofilna zbiegła się ze wzrostem glinu mózgu u mieszkańca Camelford, Cornwall, Wielka Brytania, J. Neurol. Neurosurg. Psychiatry 77 (2006) 877-879.
- C. Exley, ER House, aluminium w ludzkim mózgu, Monatsh. Chem. 142 (2011) 357- 363.
- C. Exley, T. Vickers, aluminium o podwyższonym mózgu i wczesna choroba Alzheimera u osoby zawodowo narażonej na aluminium: opis przypadku, J. Med. Case Rep. 8 (2014) 41.
- A. Mirza, A. King, C. Troakes, C. Exley, Aluminium w tkance mózgowej w rodzinnej chorobie Alzheimera, J. Trace Elem. Med. Biol. 40 (2017) 30–36.
- R. Shechter, O. Miller, G. Yovel, N. Rosenzweig, A. London i wsp., Rekrutacja korzystnych makrofagów M2 do uszkodzonego rdzenia kręgowego jest koordynowana przez zdalny splot naczyniówkowy mózgu, Immunity 38 (2013) 555-569.
- C. Exley, Toksyczność glinu u ludzi, Morphologie 100 (2016) 51-55.
- MW Salter, B. Stevens, Microglia pojawia się jako główny gracz w chorobach mózgu, Nat. Med. 23 (2017) 1018–1027.
- U. Neniskyte, CT Gross, Błędni ogrodnicy: zależne od komórek glejowych przycinanie synaptyczne i zaburzenia neurorozwojowe, Nat. Wielebny Neurosci. 18 (2017) 658–670.
- Alternatywne podejście do szczepionek skojarzonych: śródskórne podawanie izolowanych składników w celu kontroli wąglika, zatrucia jadem kiełbasianym, dżumy i toksycznego wstrząsu gronkowcowego (opublikowano w dniu Journal of Immun Based Therapies and Vaccines. 2008 września 3; 6: 5; autorzy Morefield GL, Tammariello RF i in; https://www.ncbi.nlm.nih.gov/pubmed/18768085/)
Figura 1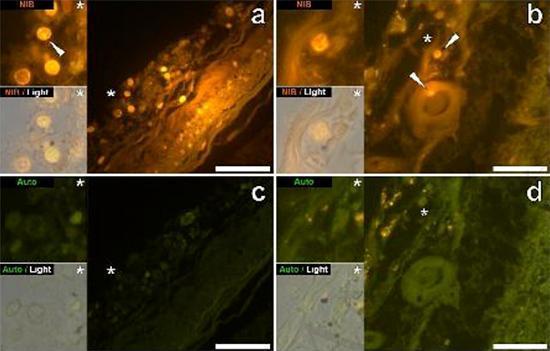
Figura 2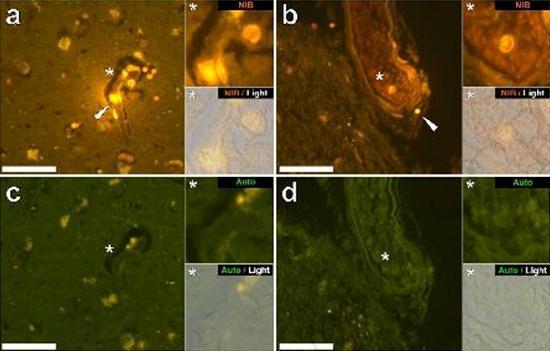
Figura 3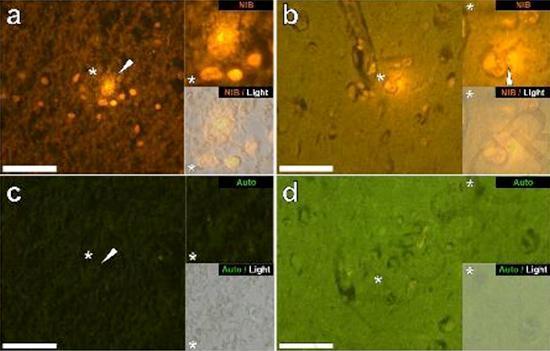
Figura 4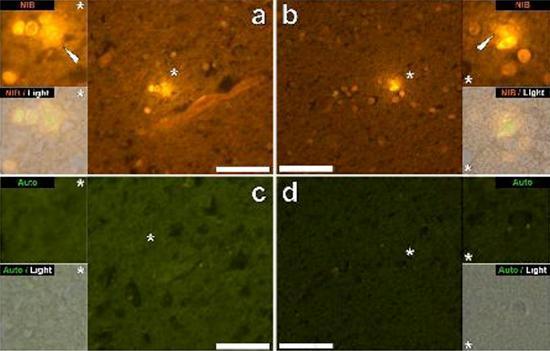
Figura 5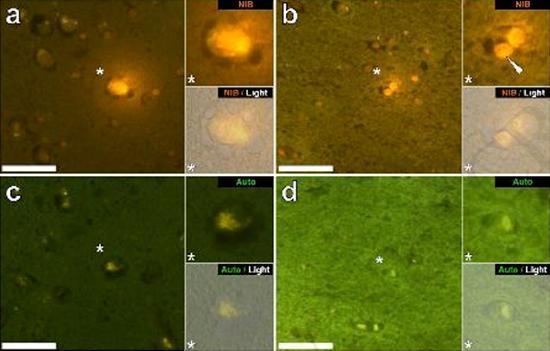
źródło: Aluminium w tkance mózgowej w autyzmie
Download: Aluminium w tkance mózgowej w autyzmie

