Czy szczepionka przeciwko półpaścowi może spowodować obrażenia i/lub śmierć?

Poniższy artykuł stara się rzucić światło na rozległy świat działań niepożądanych, ze szczególnym spojrzeniem na ten przeciwko Herpes Zoster, ale zachęcamy do przeczytania wszystkich wymienionych poniżej tematów, aby zrozumieć inne powiązane kwestie, takie jak problem wielu szczepionki, nadwrażliwość na jeden lub więcej składników szczepionki, problem SIDS i adiuwantów.
Problem wielu szczepionek (kliknij, aby otworzyć)
Problem wielu szczepionek

Obecne kalendarze szczepień, zwłaszcza dla wieku pediatrycznego, przewidują podanie wielu antygenów i szczepionek w jednej sesji, sprzyjając wygodzie kosztem bezpieczeństwa. Aby móc wygłosić konkretną wypowiedź na temat bezpieczeństwa szczepionek, musimy koniecznie wziąć pod uwagę złożoność zjawiska, doradzając wszystkim czytelnikom odpowiednie zapoznanie się ze wszystkimi aspektami szczepień, zaletami i wadami.
Dr Russell Blaylock, adiunkt kliniczny neurochirurgii w Centrum Medycznym Uniwersytetu Mississippi, przez lata badał „toksyczną synergię” i był w stanie zaobserwować, że kiedy dwa słabo toksyczne pestycydy, z których żaden nie jest w stanie wywołać zespołu Parkinsona u zwierząt doświadczalnych, są ze sobą łączone, mogą wywołać chorobę nawet szybko i porównuje to zjawisko do wielu szczepionek podawanych jednocześnie: „Szczepionki, jeśli są zbyt liczne i zbyt blisko siebie, zachowują się jak choroba przewlekła”.(A). Inne Dwa badania potwierdziły, że po zaszczepieniu wieloma szczepionkami w jednym podaniu może wystąpić nagła śmierć niemowląt.(pne)
Badanie opublikowane w Human and Experimental Toxicology wykazało, że kraje, które przepisują więcej szczepionek dzieciom, mają zwykle wyższy wskaźnik śmiertelności niemowląt.(D) Na przykład w Stanach Zjednoczonych, gdzie dzieci otrzymują 26 szczepionek, umiera ponad 6 dzieci na 1000 żywych urodzeń, podczas gdy w Szwecji i Japonii, gdzie podaje się 12 szczepionek pediatrycznych, zgłaszane są 3 zgony na każde 1000 żywych urodzeń. We wspomnianym badaniu rozważany jest również związek między szczepionkami a SIDS.
Ze szwajcarskiego badania opublikowanego w 2005 roku w European Journal of Pediatrics(E) wynika z tego, że jeśli chodzi o wpływ na wcześniaki, częstość nawracających lub nasilających się bezdechów i bradykardii po podaniu szczepionek sześciowartościowych wynosi 13%. W tym samym roku w tym samym czasopiśmie opublikowano niemieckie badanie, w którym zbadano nagłe zgony niemowląt po sześciowartościowym. Autorzy piszą: „Wyniki te, oparte na doniesieniach spontanicznych, nie dowodzą związku przyczynowego między szczepieniem a nagłą śmiercią niemowląt, ale stanowią sygnał dotyczący jednego z dwóch dostępnych sześciowartościowych; sygnał, który powinien skłonić do zintensyfikowania nadzoru nad nagłymi zgonami niemowląt po szczepieniu”.(fa)
W 2006 roku został opublikowany w czasopiśmie medycznym Vaccine(G) list od zespołu naukowców z Uniwersytetu w Monachium, który zgłosił „sześć przypadków nagłej śmierci niemowląt po szczepieniu sześciowartościowym. Wszystkie znalezione martwe bez wyjaśnienia 1-2 dni po szczepieniu”. Zostały one sklasyfikowane jako typowe przypadki nagłej śmierci niemowląt, ale autoptyczna weryfikacja wykazała nieprawidłowości neuropatologiczne i histologiczne, a wszystkie dzieci wykazywały znaczny obrzęk mózgu, co czyniło je wyjątkiem w porównaniu z innymi przypadkami SIDS (zespół nagłej śmierci niemowląt). Badacze napisali, że „Przed wprowadzeniem szczepionki sześciowartościowej (w latach 1994-2000) obserwowaliśmy przypadek tylko jednego na 198 dzieci z nagłą śmiercią łóżeczkową, które zmarło wkrótce po szczepieniu DTP. Ale w latach 2001-2004 zidentyfikowali pięć podobnych przypadków z 74 z SIDS. Oznaczałoby to trzynastokrotny wzrost”.
Również w 2006 roku w Archiwum Virchowa(H), zespół z Instytutu Patologii Uniwersytetu w Mediolanie napisał: „Eksperci z Europejskiej Agencji ds. Oceny Produktów Medycznych przeanalizowali możliwość istnienia związku między sześciowartościowymi szczepionkami a niektórymi przypadkami śmierci. Wśród uczestników byli patolodzy z doświadczeniem w szczepionkach i zespołach nagłej śmierci niemowląt, którzy prowadzili sekcje zwłok, ale, o ile nam wiadomo, niewiele uwagi poświęcono badaniu pnia mózgu i serca krwi na skrawkach seryjnych i nie było możliwości ustalenia roli wyzwalającej szczepionki na te zgony. W pracy przedstawiono przypadek 3-miesięcznej dziewczynki, która zmarła nagle po szczepieniu szczepionką sześciowartościową. Badanie pnia mózgu na seryjnych skrawkach wykazało obustronną hipoplazję jąder łukowatych. Układ przewodzący serca miał uporczywe rozproszenie i zwyrodnienie płodu. Ten przypadek oferuje wyjątkowe zrozumienie możliwej roli szczepionki sześciowartościowej w wywoływaniu śmiertelnych konsekwencji u wrażliwego dziecka. Każdy przypadek nagłej i nieoczekiwanej śmierci, który ma miejsce wkrótce po urodzeniu lub we wczesnym dzieciństwie, zwłaszcza po szczepieniu, powinien zawsze zostać poddany pełnej sekcji zwłok, zgodnie z wytycznymi.
Referencje
- Blaylock R, „Szczepienia: ukryte niebezpieczeństwa”, The Blaylock Wellness Report, maj 2004, s. 1-9
- Ottaviani G. i wsp., „Zespół nagłej śmierci łóżeczkowej (SIDS) wkrótce po szczepieniu sześciowartościowym: inna patologia w podejrzeniu SIDS?”, Virchowa Archiwum, 2006, 448, s. 100-104.
- Zinka B. i in., „Niewyjaśnione przypadki nagłej śmierci niemowląt wkrótce po szczepieniu sześciowartościowym”, Vaccine, lipiec 2006, 24 (31-32), s. 5779-5780.
- Miller NZ i in.1. , "Wskaźniki śmiertelności niemowląt regresowały w stosunku do liczby rutynowo podawanych dawek szczepionki: czy istnieje toksyczność biochemiczna lub synergistyczna?”, Hum. Exp. Toxicol., maj 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
Kwestia aluminium (kliknij, aby otworzyć)
Aluminium w szczepionkach: co rodzice powinni wiedzieć

1. Co to jest aluminium?
Aluminium to srebrzystobiały lekki metal, plastyczny i odporny. Te cechy sprawiają, że jest on przydatny w wielu branżach i produktach, m.in. maszynowej, budowlanej, magazynowej, kuchennej, przyborów kuchennych, tekstyliów, barwników i kosmetyków. Aluminium jest również metalem najobficiej występującym w skorupie ziemskiej, a praktycznie cały glin ze środowiska znajduje się w glebie. Jednak glin nie występuje naturalnie w znacznych ilościach w organizmach żywych (takich jak rośliny i zwierzęta) i nie ma żadnej znanej funkcji biologicznej. W ciągu ostatniego stulecia stosowanie aluminium w niektórych produktach doprowadziło do zwiększonego narażenia ludzi. Głównymi źródłami narażenia są żywność zawierająca glin (np. proszek do pieczenia, żywność przetworzona, odżywki dla niemowląt itp.), produkty medyczne (np. antyperspiranty, środki zobojętniające kwasy itp.), zastrzyki przeciwalergiczne i szczepionki .1-3
2. Dlaczego aluminium jest obecne w szczepionkach?
Niektóre szczepionki wykorzystują związki glinu (wodorotlenek glinu i fosforan glinu) jako adiuwanty, które są składnikami, które zwiększają odpowiedź immunologiczną na antygen (substancję obcą).4-5 Amerykańska Agencja ds. Żywności i Leków (FDA) twierdzi, że gdyby niektóre szczepionki nie zawierały aluminium, wywołana przez nie odpowiedź immunologiczna mogłaby się zmniejszyć.6
3. Jakie szczepionki zawierają aluminium?
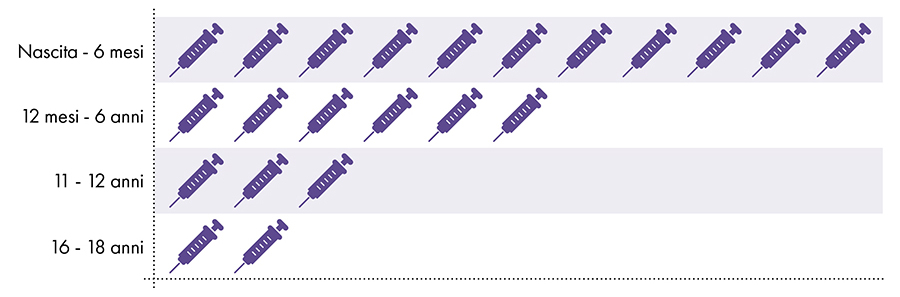
Następujące szczepionki zawierają glin i są podawane niemowlętom, dzieciom i młodzieży (ryc. 1):
- Wirusowe zapalenie wątroby typu B (HepB)
- sześciowartościowego
- Błonica, tężec i krztusiec (DTaP i Tdap)
- Haemophilus influenzae typu b (PedvaxHIB)
- Pneumokoki (PCV)
- Wirusowe zapalenie wątroby typu A (HepA)
- Wirus brodawczaka ludzkiego (HPV)
- Meningokoki B (MenB)
Rycina 1: Od urodzenia do 18 roku życia podaje się do 22 dawek szczepionek zawierających glin7-8
4. Czy narażenie na aluminium jest bezpieczne?
FDA uważa aluminium powszechnie uznawane za bezpieczne (GRAS) od 1975 roku.9 Jednak przed 1990 r. nie było technologii umożliwiającej dokładne wykrywanie niewielkich ilości glinu podawanego badanym w badaniach naukowych.10 W konsekwencji nie była znana ilość glinu, która mogłaby zostać wchłonięta przed wystąpieniem działań niepożądanych.
Od lat 1990. XX wieku, dzięki postępowi technologicznemu, zaobserwowano, że niewielkie ilości aluminium pozostające w organizmie człowieka zakłócają szereg procesów komórkowych i metabolicznych w układzie nerwowym oraz tkankach innych części ciała.1-10-11 Największe negatywne skutki aluminium zaobserwowano w układzie nerwowym i obejmują zarówno upośledzenie zdolności motorycznych, jak i encefalopatię (zmiany stanu psychicznego, zmiany osobowości, trudności w myśleniu, utrata pamięci, drgawki, śpiączka i inne).2-12
Departament Zdrowia i Opieki Społecznej Stanów Zjednoczonych (HHS) uznaje aluminium za znaną neurotoksynę.2 Ponadto FDA ostrzega przed ryzykiem toksyczności aluminium u niemowląt i dzieci.13
REJESTR FEDERALNY: Codzienna gazeta rządu Stanów Zjednoczonych„Nawet urodzone w terminie niemowlęta z prawidłową czynnością nerek mogą być zagrożone z powodu szybkiego wzrostu i niedojrzałości mózgu i szkieletu, a także niedojrzałości bariery krew-mózg. Do 1 lub 2 roku życia niemowlęta mają niższą współczynnik filtracji kłębuszkowej niż u dorosłych, co wpływa na czynność nerek. Agencja obawia się, że małe dzieci i osoby z niedojrzałą czynnością nerek są bardziej narażone na ekspozycję na glin. |
5. Ile doustnego aluminium nie jest bezpieczne?
W 2008 roku Agencja ds. Rejestru Substancji Toksycznych i Chorób (ATSDR), oddział HHS, wykorzystała badania nad neurotoksycznym działaniem glinu w celu ustalenia, że nie więcej niż 1 miligram (1.000 mikrogramów) glinu na kilogram masy ciała dziennie do unikaj negatywnych skutków aluminium.2
6. Ile wtryskiwanego aluminium nie jest bezpieczne?
Aby określić ilość glinu, którą można bezpiecznie wstrzyknąć, konieczne jest przeliczenie doustnego limitu glinu ATSDR. Limit ATSDR dla glinu podawanego doustnie (1.000 mikrogramów glinu na kilogram masy ciała na dzień) opiera się na 0,1% glinu podawanego doustnie, który jest wchłaniany do krwiobiegu, ponieważ przewód pokarmowy blokuje prawie całość glinu podawanego doustnie.2 W przeciwieństwie do tego, glin wstrzykiwany domięśniowo omija przewód pokarmowy i 100% glinu może z czasem zostać wchłonięte do krwiobiegu (tj. proporcja wchłoniętego glinu jest 1.000 razy większa). Aby uwzględnić te różne ilości wchłaniania, doustny limit glinu ATSDR należy podzielić przez 1000. Ta konwersja prowadzi do limitu glinu we krwi pochodzącego z ATSDR wynoszącego 1 mikrogram glinu (0,1% z 1.000 mikrogramów) na kilogram masy ciała na dzień. W związku z tym, aby uniknąć neurotoksycznego działania glinu, nie więcej niż 1 mikrogram glinu na kilogram masy ciała powinien dostawać się do krwiobiegu dziennie. Rycina 3 przedstawia limit glinu we krwi pochodzący z ATSDR dla niemowląt w różnym wieku w oparciu o ich wagę.
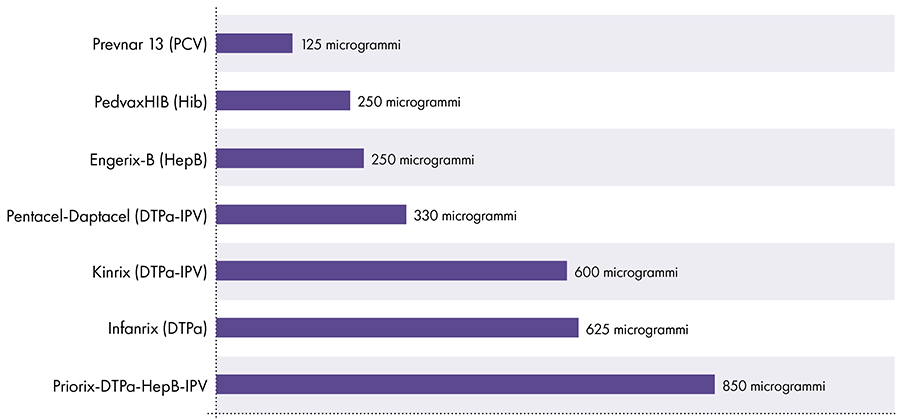
7. Ile glinu jest w szczepionkach?
Ilość glinu w szczepionkach jest różna.16 W 1968 r. rząd federalny USA ustanowił limit ilości glinu w szczepionkach na 850 mikrogramów na dawkę, w oparciu o ilość glinu potrzebną do uczynienia niektórych szczepionek skutecznymi.6-17 W konsekwencji ilość glinu w zawierających glin szczepionkach dla niemowląt waha się od 125 do 850 mikrogramów na dawkę. Rysunek 4 przedstawia zawartość glinu w jednej dawce różnych szczepionek podawanych dzieciom.
8. Czy w jakichś badaniach porównywano ilość glinu w szczepionkach z limitem ustalonym przez Agencję ds. Rejestru Substancji Toksycznych i Chorób (ATSDR)?
W 2011 roku opublikowano badanie, którego celem było porównanie ilości glinu w szczepionkach z limitem przepływu krwi określonym przez ATSDR.18 Jednak to badanie błędnie oparło swoje obliczenia na 0,78% glinu doustnego wchłoniętego do krwiobiegu, a nie na wartości 0,1% stosowanej przez ATSDR w swoich obliczeniach.19-20 W rezultacie w badaniu z 2011 r. postawiono hipotezę, że prawie 8 razy (0,78% / 0,1%) aluminium może bezpiecznie dostać się do krwioobiegu, co doprowadziło do błędnego wniosku.
9. Czy ekspozycja na aluminium ze szczepionek jest bezpieczna?
Szczepionki są wstrzykiwane domięśniowo, a szybkość migracji glinu ze szczepionek z ludzkich mięśni do krwiobiegu jest nieznana. Badania na zwierzętach sugerują, że aluminium ze szczepionek może dostać się do krwiobiegu od kilku miesięcy do ponad roku, ze względu na wiele zmiennych.21-23 Ponieważ skumulowana ekspozycja na glin ze szczepionek u dzieci poniżej pierwszego roku życia przekracza dzienny limit ustalony przez ATSDR o kilkaset (ryc. 3 i 4), limit ten nadal byłby przekroczony, gdyby glin ze szczepionek dostał się do krwiobiegu w trakcie około roku. Ponadto badania wykazały, że glin ze szczepionek jest wchłaniany przez komórki odpornościowe i dociera do części ciała znajdujących się daleko od miejsca wstrzyknięcia, w tym do mózgu.24
Zakres działań niepożądanych glinu w szczepionkach nie jest znany, ponieważ nie przeprowadzono badań bezpieczeństwa porównujących populację zaszczepioną szczepionkami zawierającymi glin z populacją nieszczepioną takimi szczepionkami.
Ograniczenie przepływu krwi przez glin pochodzące z ATSDR2-14-15
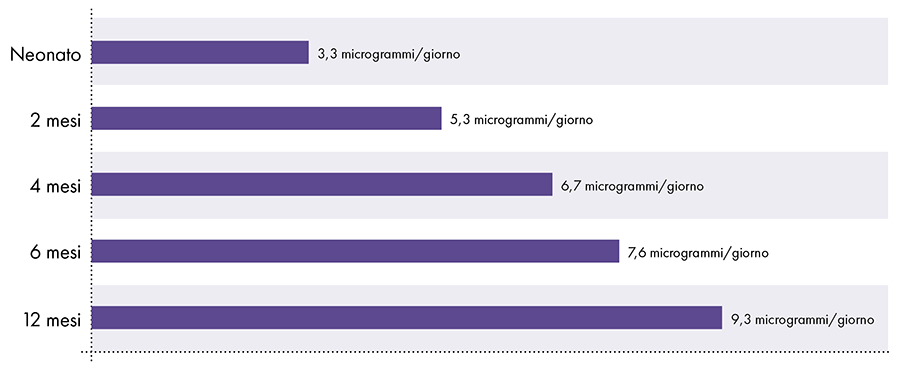 Rysunek 3: Ten wykres przedstawia limit glinu dla dzieci w różnym wieku, zgodnie z rejestrem substancji toksycznych i chorób, oddziału Departamentu Zdrowia i Opieki Społecznej Stanów Zjednoczonych. Limit wskazuje, że nie więcej niż 1 mikrogram glinu na kilogram masy ciała powinien codziennie dostawać się do krwiobiegu, aby uniknąć neurotoksycznego działania glinu.
Rysunek 3: Ten wykres przedstawia limit glinu dla dzieci w różnym wieku, zgodnie z rejestrem substancji toksycznych i chorób, oddziału Departamentu Zdrowia i Opieki Społecznej Stanów Zjednoczonych. Limit wskazuje, że nie więcej niż 1 mikrogram glinu na kilogram masy ciała powinien codziennie dostawać się do krwiobiegu, aby uniknąć neurotoksycznego działania glinu.
Ilość glinu w szczepionkach
Referencje
- Amerykańska Akademia Pediatrii, Komitet ds. Żywienia. Toksyczność glinu u niemowląt i dzieci. Pediatria. 1996 marzec; 97 (3): 413.
- Agencja ds. Rejestru Substancji Toksycznych i Chorób (ATSDR). Profil toksykologiczny dla aluminium. Waszyngton, DC: Departament Zdrowia i Opieki Społecznej USA; 2008.3, 13-24, 145, 171-7, 208.
- Jokel RA. Aluminium w żywności — charakter i udział dodatków do żywności. W: El-Samragy Y, redaktor. Dodatek do żywności. Rijeka (Chorwacja): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. W kierunku zrozumienia działania adiuwantowego aluminium. Nat Rev Immunol. 2009 kwiecień; 9 (4): 287.
- Volk VK, Bunney WE. Uodpornienie na błonicę toksoidem płynnym i toksoidem strącanym ałunem. Am J Zdrowie publiczne Zdrowie Narodów. 1942 VII; 32 (7): 690-9.
- Baylor NW, Egan W, Richman P. Sole glinu w szczepionkach — perspektywa USA. Szczepionka. 2002 31 maja; 20 dodatek 3: S18-22.
- Amerykańska Agencja ds. Żywności i Leków. Silver Spring (MD): Amerykańska Agencja ds. Żywności i Leków. Szczepionki licencjonowane do użytku w Stanach Zjednoczonych; [aktualizacja 2018 lutego 14; cytowany 2018 lutego 27 r.]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- Centra Kontroli i Zapobiegania Chorobom. Waszyngton, DC: Departament Zdrowia i Opieki Społecznej USA. Zalecany harmonogram szczepień dla dzieci i młodzieży w wieku 18 lat lub młodszych, Stany Zjednoczone, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- Amerykańska Agencja ds. Żywności i Leków. Silver Spring (MD): Amerykańska Agencja ds. Żywności i Leków. SCOGS (Komitet Specjalny ds. Substancji GRAS); [cytowano 2018]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- Ks. ND. Zachowanie biologiczne i biodostępność glinu u człowieka, ze szczególnym uwzględnieniem badań z wykorzystaniem glinu-26 jako znacznika: przegląd i aktualizacja badania. J Monitorowanie środowiska. 2004; 6: 376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. Glin w pediatrycznych produktach do żywienia pozajelitowego: zawartość zmierzona w porównaniu z zawartością oznaczoną. J Pediatr Pharmacol Ther. 2011; 16 (2): 92-7.
- Sedman A. Toksyczność glinu w dzieciństwie. Pediatr Nefrol. 1992 lipiec; 6 (4): 383-93.
- Amerykańska Agencja ds. Żywności i Leków, Departament Zdrowia i Opieki Społecznej. Zasady i przepisy. Rejestr Fed. 2003 czerwiec; 68 (100): 34286.
- Centra Kontroli i Zapobiegania Chorobom. Waszyngton, DC: Departament Zdrowia i Opieki Społecznej USA. National Center for Health Statistics: Tabela danych dla wykresów długości i wieku chłopców w zależności od wieku; [cyt. 2019 kwietnia 2]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- Centra Kontroli i Zapobiegania Chorobom. Waszyngton, DC: Departament Zdrowia i Opieki Społecznej USA. National Center for Health Statistics: Tabela danych dla wykresów długości i wagi dziewcząt w zależności od wieku; [cyt. 2019 kwietnia 2]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- Amerykańska Agencja ds. Żywności i Leków, Departament Zdrowia i Opieki Społecznej. Rewizja wymagań dotyczących materiałów składowych. Ostateczna zasada. Rejestr Fed. 2011 kwietnia 13; 76 (71): 20513-8.
- Biuro Rejestru Federalnego, Krajowa Służba Archiwów i Rejestrów, Administracja Usług Ogólnych. Zasady i przepisy. Rejestr Fed. 1968 styczeń; 33 (6): 369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. Zaktualizowana farmakokinetyka glinu po narażeniu niemowląt poprzez dietę i szczepienia. Szczepionka. 2011 listopada 28; 29 (51): 9538-43.
- Miller S, lekarze za świadomą zgodę. Errata w „Zaktualizowanej farmakokinetyce glinu w następstwie narażenia niemowląt poprzez dietę i szczepienia”. W: Brama Badań. Berlin (Niemcy): ResearchGate GmbH; 2020 marca 6 [cytowano 2020 marca 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- Lekarze za świadomą zgodę. Newport Beach (Kalifornia): Lekarze za świadomą zgodę. Errata w „Zaktualizowanej farmakokinetyce glinu w następstwie narażenia niemowląt poprzez dietę i szczepienia”; [cytowano 2020 marca 6 r.]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, Biały JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. Absorpcja in vivo adiuwantów szczepionkowych zawierających glin przy użyciu 26A1997. Szczepionka 15 sierpień-wrzesień; 12 (13-1314): 8-XNUMX.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. Oznaczenie aluminium i ocena reakcji miejscowej w kilku punktach czasowych po domięśniowym podaniu szczepionek zawierających aluminium u małpy Cynomolgus. Szczepionka. 2005 lutego 3; 23 (11): 1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanisławski B. Aluminium w osoczu i tkankach po wstrzyknięciu domięśniowym adiuwantów ludzkich szczepionek u szczurów. Arch toksykol. 2019 październik; 93 (10): 2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. Analiza krytyczna badań referencyjnych dotyczących toksykokinetyki adiuwantów na bazie glinu. J Inorg Biochem. 2018 kwiecień 181: 87-95.
Artykuł przetłumaczony przez Lekarze dla świadomej zgody
Zgodnie z ulotką dołączoną do szczepionki Shingrix, działania niepożądane zgłaszane podczas badania klinicznego obejmowały ból, obrzęk i zaczerwienienie w miejscu wstrzyknięcia, ból głowy, gorączkę, zmęczenie, dreszcze, problemy żołądkowo-jelitowe, dnę moczanową i niedokrwienną neuropatię nerwu wzrokowego.(1) Firma GlaxoSmithKline zobowiązała się do przeprowadzenia wielu badań postmarketingowych szczepionki SHINGRIX, na którą uzyskała licencję w 2017 r. Zgodnie z danymi przedstawionymi przez amerykańskie Centra Kontroli i Zapobiegania Chorobom (CDC) na posiedzeniu Komitetu Doradczego ds. Szczepień (ACIP) w czerwcu 2018 r. Większość zgłoszenia dotyczyły kobiet i nie były poważnymi zdarzeniami; najczęstszą reakcją był ból w miejscu wstrzyknięcia.(2)
Na spotkaniu ACIP w lutym 2019 r. dr Tom Shimabukuro z Biura ds. Bezpieczeństwa Szczepień (ISO) CDC poinformował o potencjalnym sygnale bezpieczeństwa związanym ze szczepionką SHINGRIX. Związek między zespołem Guillain-Barré (GBS) a szczepionką został znaleziony w Vaccine Safety Datalink (VSD) i Vaccine Adverse Events Reporting System (VAERS). GBS jest rzadką chorobą neurologiczną, która powoduje zapalenie nerwów obwodowych. Powikłania mogą obejmować czasowy lub przewlekły paraliż, w tym całkowity paraliż ciała.(3)
CDC, FDA i Centers for Medicare and Medicaid Services (CMS) przeprowadziły przegląd danych z bazy danych roszczeń Medicare. Według FDA:(4) „Ryzyko GBS po szczepieniu szczepionką Shingrix oceniano w analizach serii przypadków z samokontrolą, stosując okno ryzyka od 1 do 42 dni po szczepieniu i okno kontrolne od 43 do 183 dni po szczepieniu. Analiza pierwotna wykazała zwiększone ryzyko GBS w ciągu 42 dni po szczepieniu szczepionką Shingrix, z szacowanym nadmiarem przypadków GBS wynoszącym 3 na milion dawek podanych dorosłym w wieku 65 lat i starszym. Zwiększone ryzyko GBS zaobserwowano w ciągu 42 dni po podaniu pierwszej dawki szczepionki Shingrix, z oszacowano 6 dodatkowych przypadków GBS na milion dawek podanych osobom dorosłym w wieku 65 lat i starszym, przy jednoczesnym braku zwiększonego ryzyka GBS po drugiej dawce szczepionki Shingrix. Te analizy rozpoznań GBS w danych roszczeń zostały poparte analizami przypadków GBS potwierdzonymi przeglądem dokumentacji medycznej ”.
FDA ustaliła związek między Shingrix i GBS, ale obecne dane nie są dostępne, aby ustalić związek przyczynowy. Doszedł jednak do wniosku, że przegląd sekcji "Ostrzeżenia i środki" ulotki dołączonej do opakowania SHINGRIX dotyczącej ryzyka GBS było uzasadnione.(5)
Dodatkowe działania niepożądane zgłaszane po zatwierdzeniu szczepionki Shingrix obejmowały reakcje alergiczne, obrzęk naczynioruchowy, pokrzywkę i wysypkę oraz zmniejszoną ruchomość w ramieniu szczepionki.(6)
Zdarzenia niepożądane zgłaszane w badaniach klinicznych lub po wprowadzeniu szczepionki Zostavax do obrotu obejmowały ból, obrzęk i zaczerwienienie w miejscu wstrzyknięcia, ból głowy, wysypkę skórną przypominającą półpasiec, gorączkę, wstrząs, ból stawów i mięśni, obrzęk węzłów chłonnych i objawy ze strony układu oddechowego.(7) W opublikowanym studium przypadku opisano również zapalenie nerwu wzrokowego po podaniu szczepionki Zostavax.(8)
Ulotka dołączona do opakowania Zostavax stwierdza, że „Może dojść do transmisji wirusa szczepionkowego między zaszczepionymi a podatnymi kontaktami,”(9) to znaczy, zaszczepiony osobnik zaraża ospą wietrzną szczepu szczepionkowego i może zarażać ospą wietrzną innych, jeśli wcześniej nie chorowali na ospę wietrzną.
Merck, producent Zostavax, broni obecnie 60 procesów sądowych, w których twierdzi, że szczepionka spowodowała poważne skutki uboczne, w tym śmierć. Wynik tego postępowania jest w toku.(10) Sprzedaż Zostavax w Stanach Zjednoczonych została zakończona w listopadzie 2020 r.(11)
Merck, producent Zostavax, obecnie pozywa i broni się przed pozwami, w których twierdzi, że szczepionka spowodowała poważne skutki uboczne, w tym śmierć.(12) W grudniu 2022 r. sędzia federalny Pensylwanii odrzucił prawie 1.200 roszczeń dotyczących półpaśca po szczepionce Zostavax. Twierdzenia zostały podobno odrzucone przez sędziego z powodu braku dowodów na to, że wysypka półpaśca była związana ze szczepionką. Inne procesy sądowe dotyczące zaburzeń autoimmunologicznych i utraty słuchu są w toku.(13)
Referencje (kliknij, aby otworzyć)
- Biologia firmy GlaxoSmithKline. Ulotka informacyjna — SHINGRIX. Amerykańska Agencja ds. Żywności i Leków 2 sierpnia 2021 r.
- Amerykańskie Centra Kontroli i Zapobiegania Chorobom. Czerwiec 2018 Protokół ACIP, Czerwiec 2018.
- Wrangham T. ACIP: 2018-2019 Skuteczność szczepionki przeciw grypie w 44 procentach. Krajowe Centrum Informacji Vaccine 7 kwietnia 2019 r.
- Amerykańska Agencja ds. Żywności i Leków. FDA wymaga umieszczenia ostrzeżenia o zespole Guillain-Barré (GBS) w drukach informacyjnych dotyczących szczepionki Shingrix. 24 marca 2021 r.
- Amerykańska Agencja ds. Żywności i Leków. FDA wymaga umieszczenia ostrzeżenia o zespole Guillain-Barré (GBS) w drukach informacyjnych dotyczących szczepionki Shingrix. 24 marca 2021 r.
- Biologia firmy GlaxoSmithKline. Ulotka informacyjna — SHINGRIX. Amerykańska Agencja ds. Żywności i Leków 2 sierpnia 2021 r.
- Merck & Co. Ulotka informacyjna — Zostavax (mrożony). Amerykańska Agencja ds. Żywności i Leków Dec. 26, 2019.
- Han S. Zapalenie nerwu wzrokowego po szczepieniu przeciwko Varicella zoster: opis dwóch przypadków. Szczepionka 3 września 2014; 32(39):4881-4.
- Merck & Co. Ulotka informacyjna — Zostavax (mrożony). Amerykańska Agencja ds. Żywności i Leków Dec. 26, 2019.
- Luhana, r. Merck składa wniosek o konsolidację pozwów Zostavax na Florydzie. Egzaminator Prawny May 30, 2018.
- Amerykańskie Centra Kontroli i Zapobiegania Chorobom. Co każdy powinien wiedzieć o Zostavax. 5 października 2020 r.
- Luhana, r. Merck składa wniosek o konsolidację pozwów Zostavax na Florydzie. Egzaminator Prawny May 30, 2018.
- Kansteiner F. Merck unika prawie 1,200 pozwów przeciwko szczepionce na półpasiec Zostavax, ponieważ zeznania powodów są niewystarczające. Ostra apteka Dec. 8, 2022.
Ten artykuł został podsumowany i przetłumaczony przez Krajowe Centrum Informacji Vaccine.

