האם החיסון נגד פנאומוקוק יכול לגרום לפציעה ו/או מוות?

הערה חשובה: Corvelva מזמינה אותך לקבל מידע מעמיק על ידי קריאת כל הסעיפים והקישורים, כמו גם עלוני המוצר ודפי הנתונים הטכניים של היצרן, ולשוחח עם איש מקצוע מהימן אחד או יותר לפני שתחליט לחסן את עצמך או את ילדך. מידע זה מיועד למטרות מידע בלבד ואינו מיועד לייעוץ רפואי.
הבעיה של ריבוי חיסונים (לחץ לפתיחה)
הבעיה של ריבוי חיסונים

לוחות החיסונים הנוכחיים, במיוחד לגיל הילדים, מספקים מתן אנטיגנים וחיסונים מרובים בפגישה אחת, תוך מתן נוחות על חשבון בטיחות. על מנת שנוכל לשאת נאום ספציפי על בטיחות החיסונים, עלינו בהכרח לקחת בחשבון את מורכבות התופעה, ולהמליץ לכל הקוראים ליידע את עצמם כראוי בכל היבטי החיסון, בעד ונגד.
ד"ר ראסל בלילוק, פרופסור קליני לנוירוכירורגיה במרכז הרפואי של אוניברסיטת מיסיסיפי, חקר "סינרגיה רעילה" במשך שנים והצליח להבחין שכאשר שני חומרי הדברה רעילים חלשים, שבהם אף אחד מהם אינו מסוגל לגרום לתסמונת פרקינסון בחיות ניסוי, משולבים זה בזה, עלולים לגרום למחלה אפילו במהירות ומשווה תופעה זו לזו של מספר חיסונים הניתנים בו זמנית: "חיסונים, אם הם רבים מדי וקרובים מדי זה לזה, מתנהגים כמו מחלה כרונית".(). אחרים שני מחקרים אישרו שמוות פתאומי של תינוקות יכול להתרחש לאחר חיסון של מספר חיסונים במתן יחיד.(לִפנֵי הַסְפִירָה)
מחקר שפורסם ב- Human and Experimental Toxicology הראה שמדינות הרושמות יותר חיסונים בילדים נוטות לקבל שיעורי תמותת תינוקות גבוהים יותר.(ד) לדוגמה, בארצות הברית, שבה ילדים מקבלים 26 חיסונים, מתים יותר מ-6 ילדים לכל 1000 לידות חי, בעוד שבשבדיה וביפן, שבהן ניתנים 12 חיסונים לילדים, מדווחים 3 מקרי מוות על כל 1000 לידות חי. במחקר הנ"ל, נחשב גם הקשר בין חיסונים ל-SIDS.
מתוך מחקר שוויצרי שפורסם ב-2005 ב-European Journal of Pediatrics(ה) התוצאה היא שלגבי ההשפעות על פגים, השכיחות של דום נשימה וברדיקרדיה חוזרת או מוגברת לאחר מתן חיסונים משושה היא 13%. באותה שנה פרסם אותו כתב עת מחקר גרמני שבדק מקרי מוות פתאומי של תינוקות לאחר משושה. המחברים כותבים: «תוצאות אלו, המבוססות על דיווחים ספונטניים, אינן מוכיחות קשר סיבתי בין חיסון למוות פתאומי של תינוקות, אלא מהוות איתות לגבי אחד משני המשושים הזמינים; אות שאמור להוביל להגברת המעקב אחר מקרי מוות פתאומי של תינוקות לאחר חיסון".(ו)
בשנת 2006 הוא פורסם בכתב העת הרפואי Vaccine(ז) המכתב של צוות חוקרים מאוניברסיטת מינכן שדיווח על "שישה מקרים של מוות פתאומי של תינוקות לאחר חיסון משושה. כולם נמצאו מתים ללא הסבר 1-2 ימים לאחר החיסון". הם סווגו כמקרים טיפוסיים של מוות פתאומי של תינוקות, אך האימות האוטופטי גילה חריגות נוירופתולוגיות והיסטולוגיות וכל הילדים הראו בצקת מוחית משמעותית שהפכה אותם לחריגים בהשוואה למקרי SIDS אחרים (תסמונת מוות בעריסה). החוקרים כתבו כי "לפני כניסת החיסון המשושה (בשנים 1994-2000), ראינו מקרה של רק אחד מכל 198 ילדים עם מוות פתאומי של תינוקות שמתו זמן קצר לאחר חיסון ה-DTP. אבל בין 2001 ל-2004 הם זיהו חמישה מקרים דומים מתוך 74 עם SIDS. זה יצביע על עלייה של פי XNUMX".
גם בשנת 2006 בארכיון Virchows(ח), צוות המכון לפתולוגיה של אוניברסיטת מילאנו כתב: «מומחים מהסוכנות האירופית להערכת מוצרים רפואיים ניתחו את האפשרות שיכול להיות קשר בין חיסונים משושה למקרים מסוימים של מוות. המשתתפים כללו פתולוגים בעלי ניסיון בחיסונים ותסמונת מוות פתאומי של תינוקות שערכו את הנתיחה, אך ככל הידוע לנו, תשומת לב מועטה הוקדשה לבדיקת גזע המוח ולב הדם בחתכים סדרתיים ולא הייתה אפשרות לקבוע תפקיד טריגר של החיסון למקרי מוות אלו. כאן אנו מדווחים על מקרה של ילדה בת 3 חודשים שמתה בפתאומיות לאחר חיסון משושה. בדיקה של גזע המוח בחתכים סדרתיים גילתה היפופלזיה של גרעין קשתי דו-צדדי. למערכת ההולכה של הלב הייתה פיזור וניוון עובריים מתמשכים. מקרה זה מציע הבנה ייחודית של התפקיד האפשרי של החיסון המשושה בהפעלת תוצאה קטלנית בילד פגיע. כל מקרה של מוות פתאומי ובלתי צפוי המתרחש זמן קצר לאחר הלידה או בילדות המוקדמת, במיוחד אם בעקבות חיסון, צריך תמיד לעבור נתיחה מלאה, בהתאם להנחיות.
ריפרימינטי
- Blaylock R, "Vaccinations: the hidden dangers", The Blaylock Wellness Report, מאי 2004, עמ' 1-9
- Ottaviani G. וחב', "תסמונת מוות פתאומי של תינוקות (SIDS) זמן קצר לאחר חיסון משושה: פתולוגיה נוספת בחשד ל- SIDS?", Virchows ארכיון, 2006, 448, עמ'. 100-104.
- זינקה ב' ואח', "מקרים בלתי מוסברים של מוות פתאומי של תינוקות זמן קצר לאחר חיסון משושה", Vaccine, יולי 2006, 24 (31-32), עמ'. 5779-5780.
- מילר NZ et al1. , "שיעורי תמותת התינוקות ירדו לעומת מספר מנות החיסון הניתנות באופן שגרתי: האם יש רעילות ביוכימית או סינרגטית?", Hum. Exp. Toxicol., מאי 2011.
- https://pubmed.ncbi.nlm.nih.gov/15843978/
- https://pubmed.ncbi.nlm.nih.gov/15602672/
- https://pubmed.ncbi.nlm.nih.gov/15908063/
- https://pubmed.ncbi.nlm.nih.gov/16231176/
בעיית האלומיניום (לחץ לפתיחה)
אלומיניום בחיסונים: מה שהורים צריכים לדעת

1. מהו אלומיניום?
האלומיניום היא מתכת קלה בצבע לבן כסוף, ניתנת לגימור ועמידה. תכונות אלו הופכות אותו לשימושי בתעשיות ומוצרים רבים, כולל מכונות, בנייה, מחסנים, כלי בישול, כלי מטבח, טקסטיל, צבעים וקוסמטיקה. האלומיניום היא גם המתכת הנפוצה ביותר בקרום כדור הארץ, ולמעשה כל האלומיניום בסביבה נמצא באדמה. עם זאת, אלומיניום אינו מצוי באופן טבעי בכמויות משמעותיות באורגניזמים חיים (כגון צמחים ובעלי חיים) ואין לו שום תפקיד ביולוגי ידוע. במהלך המאה האחרונה, השימוש באלומיניום במוצרים מסוימים הוביל לחשיפה מוגברת של בני אדם. מקורות החשיפה העיקריים הם מזונות המכילים אלומיניום (כגון אבקת אפייה, מזון מעובד, פורמולות לתינוקות וכו'), מוצרים רפואיים (כגון נוגדי זיעה, נוגדי חומצה וכו'), זריקות אלרגיה וחיסונים.1-3
2. מדוע קיים אלומיניום בחיסונים?
חלק מהחיסונים משתמשים בתרכובות אלומיניום (אלומיניום הידרוקסיד ואלומיניום פוספט) כעזרים, שהם מרכיבים המגבירים את התגובה החיסונית לאנטיגן (חומר זר).4-5 מינהל המזון והתרופות האמריקאי (FDA) אומר שאם חלק מהחיסונים לא יכללו אלומיניום, התגובה החיסונית שהם מפעילים עלולה לרדת.6
3. אילו חיסונים מכילים אלומיניום?
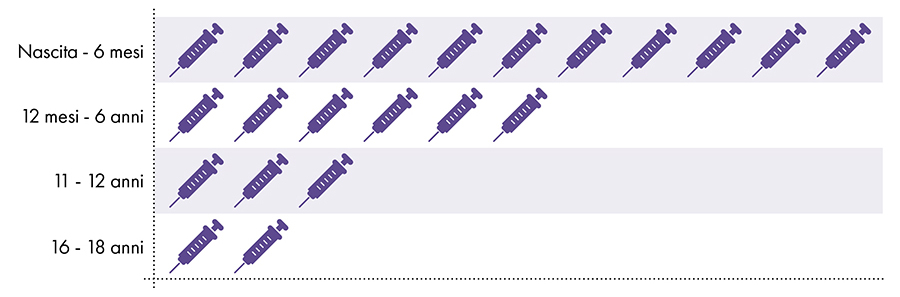
החיסונים הבאים מכילים אלומיניום וניתנים לתינוקות, ילדים ומתבגרים (איור 1):
- הפטיטיס B (HepB)
- hexavalent
- דיפתריה, טטנוס ושעלת (DTaP ו-Tdap)
- Haemophilus influenzae סוג b (PedvaxHIB)
- פנאומוקוק (PCV)
- הפטיטיס A (HepA)
- וירוס הפפילומה האנושי (HPV)
- Meningococcus B (MenB)
איור 1: עד 18 מנות של חיסונים המכילים אלומיניום ניתנות מלידה ועד גיל 227-8
4. האם חשיפה לאלומיניום בטוחה?
ה-FDA ראה אלומיניום מוכר בדרך כלל כבטוח (GRAS) מאז 1975.9 עם זאת, לפני 1990, לא הייתה טכנולוגיה לזיהוי מדויק של כמויות קטנות של אלומיניום שניתנו לנבדקים במחקרים מדעיים.10 כתוצאה מכך, כמות האלומיניום שיכולה להיספג לפני הופעת ההשפעות השליליות לא הייתה ידועה.
מאז שנות ה-1990, הודות להתקדמות הטכנולוגית, נצפה שהכמויות הקטנות של אלומיניום שנותרו בגוף האדם מפריעות למספר תהליכים תאיים ומטבוליים במערכת העצבים וברקמות של חלקים אחרים בגוף.1-10-11 ההשפעות השליליות הגדולות ביותר של האלומיניום נצפו במערכת העצבים והן נעות בין פגיעה במיומנויות מוטוריות ועד אנצפלופתיה (שינוי במצב נפשי, שינויים באישיות, קשיי חשיבה, אובדן זיכרון, התקפים, תרדמת ועוד).2-12
מחלקת הבריאות ושירותי האנוש של ארצות הברית (HHS) מכירה באלומיניום בתור רעלן עצבי ידוע.2 בנוסף, ה-FDA הזהיר מפני הסיכונים של רעילות אלומיניום אצל תינוקות וילדים.13
רישום פדרלי: העיתון היומי של ממשלת ארצות הברית"אפילו תינוקות בלידה מלאה עם תפקוד כליות תקין עלולים להיות בסיכון בגלל גדילה מהירה וחוסר בשלות של המוח והשלד, כמו גם חוסר בשלות של מחסום הדם-מוח. עד גיל 1 או שנתיים, לתינוקות יש רמה נמוכה יותר קצב סינון גלומרולרי מאשר מבוגרים, המשפיע על תפקוד הכליות שלהם. הסוכנות חוששת שילדים צעירים ואלה עם תפקוד כליות לא בשל נמצאים בסיכון מוגבר לחשיפה לאלומיניום". |
5. כמה אלומיניום דרך הפה אינו בטוח?
בשנת 2008, הסוכנות לחומרים רעילים ומחלות רישום (ATSDR), חטיבה של HHS, השתמשה במחקרים על ההשפעות הנוירוטוקסיות של אלומיניום כדי לקבוע שלא יותר ממיליגרם (1 מיקרוגרם) אלומיניום לכל קילוגרם משקל גוף ליום. להימנע מההשפעות השליליות של האלומיניום.2
6. כמה אלומיניום מוזרק אינו בטוח?
כדי לקבוע את כמות האלומיניום שניתן להזריק בבטחה יש צורך להמיר את גבול האלומיניום הפה של ATSDR. מגבלת ה-ATSDR לאלומיניום דרך הפה (1.000 מיקרוגרם אלומיניום לק"ג משקל גוף ליום) מבוססת על 0,1% מהאלומיניום דרך הפה שנספג לזרם הדם, שכן מערכת העיכול חוסמת כמעט את כל האלומיניום דרך הפה.2 לעומת זאת, אלומיניום המוזרק לשריר עוקף את מערכת העיכול ו-100% מהאלומיניום יכול להיספג בזרם הדם לאורך זמן (כלומר, שיעור האלומיניום הנספג גדול פי 1.000). כדי לתת את הדעת לכמויות השונות הללו של ספיגה, יש לחלק את גבול האלומיניום הפה של ה-ATSDR ב-1000. המרה זו מובילה למגבלה של אלומיניום בדם שמקורו ב-ATSDR של 1 מיקרוגרם אלומיניום (0,1% מ-1.000 מיקרוגרם) לק"ג משקל גוף ליום. כתוצאה מכך, כדי למנוע את ההשפעות הנוירוטוקסיות של אלומיניום, לא יותר מ-1 מיקרוגרם של אלומיניום לכל קילוגרם ממשקל הגוף צריך להיכנס לזרם הדם על בסיס יומי. איור 3 מציג את גבול האלומיניום בדם שמקורו ב-ATSDR עבור תינוקות בגילאים שונים על סמך משקלם.
7. כמה אלומיניום יש בחיסונים?
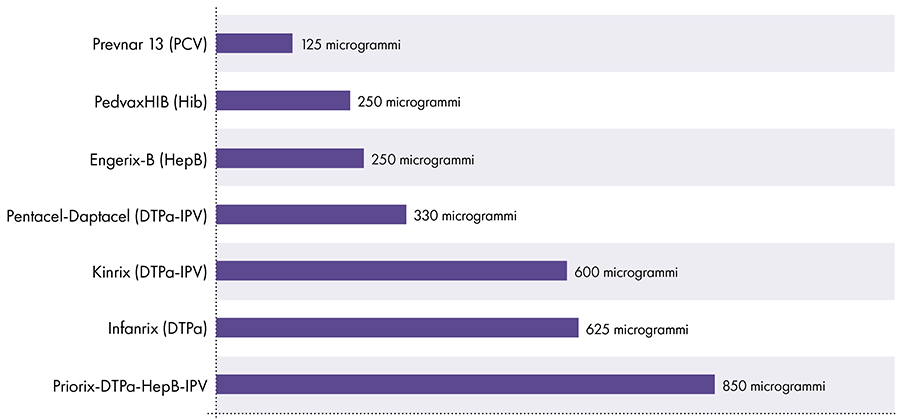
כמות האלומיניום בחיסונים משתנה.16 בשנת 1968, הממשל הפדרלי בארה"ב קבע את הגבול לכמות האלומיניום בחיסונים ל-850 מיקרוגרם למנה, בהתבסס על כמות האלומיניום הדרושה כדי להפוך חלק מהחיסונים ליעילים.6-17 כתוצאה מכך, כמות האלומיניום בחיסוני תינוקות המכילים אלומיניום נעה בין 125 ל-850 מיקרוגרם למנה. איור 4 מציג את תכולת האלומיניום של מנה אחת של חיסונים שונים שניתנו לילדים.
8. האם מחקרים כלשהם השוו את כמות האלומיניום בחיסונים עם המגבלה שנגזרת מהסוכנות לרישום חומרים רעילים ומחלות (ATSDR)?
בשנת 2011 פורסם מחקר שמטרתו להשוות את כמות האלומיניום בחיסונים עם מגבלת זרימת הדם שנקבעה על ידי ה-ATSDR.18 עם זאת, מחקר זה ביסס באופן שגוי את החישובים שלו על 0,78% אלומיניום דרך הפה שנספג בזרם הדם, ולא על הערך של 0,1% ששימש את ה-ATSDR בחישוביו.19-20 כתוצאה מכך, המחקר משנת 2011 שיער כי כמעט פי 8 (0,78% / 0,1%) אלומיניום יכול להיכנס בבטחה לזרם הדם, וזה הוביל למסקנה שגויה.
9. האם חשיפה לאלומיניום מחיסונים בטוחה?
חיסונים מוזרקים לשריר, וקצב נדידת האלומיניום מחיסונים משריר אנושי לזרם הדם אינו ידוע. מחקרים בבעלי חיים מצביעים על כך שלאלומיניום מחיסונים יכול להימשך בין מספר חודשים ליותר משנה להיכנס לזרם הדם, עקב משתנים מרובים.21-23 מאחר שהחשיפה המצטברת לאלומיניום מחיסונים בילדים מתחת לגיל שנה חורגת מהגבול היומי שנקבע על ידי ה-ATSDR בכמה מאות (איור 3 ו-4), עדיין תחרוג מהגבול אם אלומיניום מחיסונים ייכנס לזרימת הדם במהלך בערך שנה. יתר על כן, כמה מחקרים הראו שאלומיניום מחיסונים נספג בתאי מערכת החיסון ומגיע לחלקים בגוף הרחוקים ממקום ההזרקה, כולל למוח.24
היקף ההשפעות השליליות של אלומיניום בחיסונים אינו ידוע, שכן לא נערכו מחקרי בטיחות המשווים בין אוכלוסיה מחוסנת עם חיסונים המכילים אלומיניום לאוכלוסייה שאינה מחוסנת בחיסונים כאלה.
הגבלת אלומיניום בזרימת הדם שמקורה ב-ATSDR2-14-15
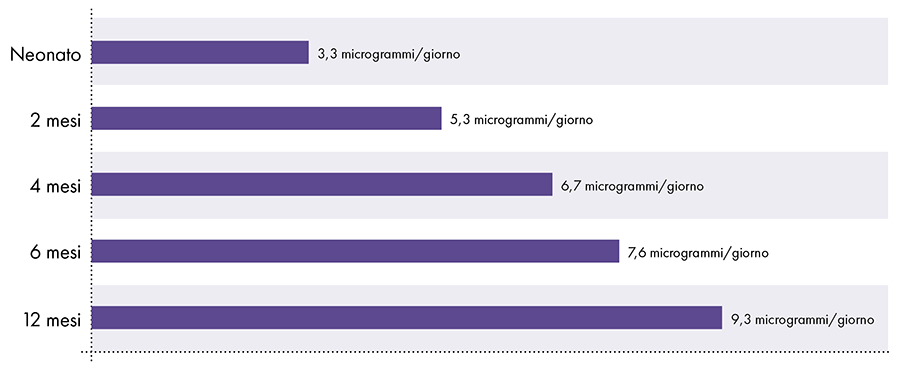 איור 3: גרף זה מציג את מגבלת האלומיניום לילדים בגילאים שונים, כפי שנגזר ממרשם החומרים הרעילים והמחלות, חטיבה של מחלקת הבריאות ושירותי האנוש של ארצות הברית. המגבלה מציינת שלא יותר מ-1 מיקרוגרם של אלומיניום לכל קילוגרם ממשקל הגוף צריך להיכנס לזרם הדם על בסיס יומי כדי למנוע את ההשפעות הנוירוטוקסיות של האלומיניום.
איור 3: גרף זה מציג את מגבלת האלומיניום לילדים בגילאים שונים, כפי שנגזר ממרשם החומרים הרעילים והמחלות, חטיבה של מחלקת הבריאות ושירותי האנוש של ארצות הברית. המגבלה מציינת שלא יותר מ-1 מיקרוגרם של אלומיניום לכל קילוגרם ממשקל הגוף צריך להיכנס לזרם הדם על בסיס יומי כדי למנוע את ההשפעות הנוירוטוקסיות של האלומיניום.
כמות אלומיניום בחיסונים
ריפרימינטי
- האקדמיה האמריקאית לרפואת ילדים, הוועדה לתזונה. רעילות אלומיניום אצל תינוקות וילדים. רפואת ילדים. 1996 מרץ; 97 (3): 413.
- הסוכנות לחומרים רעילים ומרשם מחלות (ATSDR). פרופיל טוקסיקולוגי לאלומיניום. וושינגטון הבירה: משרד הבריאות ושירותי האנוש האמריקאי; 2008.3, 13-24, 145, 171-7, 208.
- יוקל ר.א. אלומיניום במזון - טבעם ותרומתם של תוספי מזון. בתוך: אל-סמראגי י, עורך. תוסף מזון. רייקה (קרואטיה): InTech; 2012. 203-28.
- Marrack P, McKee AS, Munks MW. לקראת הבנת פעולתו האדג'ובנטית של האלומיניום. Nat Rev Immunol. 2009 באפריל; 9 (4): 287.
- Volk VK, Bunney WE. חיסון דיפטריה עם טוקסואיד נוזלי וטוקסואיד מושקע באלום. Am J Public Health Nations Health. 1942 יולי; 32 (7): 690-9.
- Baylor NW, Egan W, Richman P. מלחי אלומיניום בחיסונים - פרספקטיבה של ארה"ב. תַרכִּיב. 2002 31 במאי; 20 תוספת 3: S18-22.
- מנהל המזון והתרופות האמריקאי. סילבר ספרינג (MD): מנהל המזון והתרופות האמריקאי. חיסונים מורשים לשימוש בארצות הברית; [עודכן 2018 בפברואר 14; מצוטט 2018 בפברואר 27]. https://www.fda.gov/BiologicsBloodVaccines/Vaccines/ApprovedProducts/Ucm093833.htm.
- מרכזים לבקרת מחלות ומניעתן. וושינגטון הבירה: משרד הבריאות ושירותי האנוש האמריקאי. לוח חיסונים מומלץ לילדים ובני נוער מגיל 18 ומטה, ארצות הברית, 2018. https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf.
- מנהל המזון והתרופות האמריקאי. סילבר ספרינג (MD): מנהל המזון והתרופות האמריקאי. SCOGS (וועדה נבחרה לחומרי GRAS); [מצוטט 2018 16 באוגוסט]. https://www.accessdata.fda.gov/scripts/fdcc/?set=SCOGS.
- כומר נ.ד. ההתנהגות הביולוגית והזמינות הביולוגית של אלומיניום באדם, תוך התייחסות מיוחדת למחקרים המשתמשים באלומיניום-26 כחומר מעקב: סקירה ועדכון מחקר. J Environ Monit. 2004; 6: 376,392.
- Poole RL, Pieroni KP, Gaskari S, Dixon TK, Park KT, Kerner JA. אלומיניום במוצרי תזונה פרנטרלית לילדים: נמדד לעומת תוכן מסומן. J Pediatr Pharmacol Ther. 2011; 16 (2): 92-7.
- סדמן א. רעילות אלומיניום בילדות. רופא ילדים נפרול. 1992 יולי; 6 (4): 383-93.
- מינהל המזון והתרופות האמריקאי, משרד הבריאות ושירותי האנוש. חוקים ותקנות. רישום הפד. 2003 יוני; 68 (100): 34286.
- מרכזים לבקרת מחלות ומניעתן. וושינגטון הבירה: משרד הבריאות ושירותי האנוש האמריקאי. המרכז הלאומי לסטטיסטיקת בריאות: טבלת נתונים עבור טבלאות אורך לגיל ומשקל לגיל של בנים; [מצוטט 2019 2 באפריל]. https://www.cdc.gov/growthcharts/who/boys_length_weight.htm.
- מרכזים לבקרת מחלות ומניעתן. וושינגטון הבירה: משרד הבריאות ושירותי האנוש האמריקאי. המרכז הלאומי לסטטיסטיקת בריאות: טבלת נתונים עבור טבלאות אורך לגיל ומשקל לגיל של בנות; [מצוטט 2019 2 באפריל]. https://www.cdc.gov/growthcharts/who/girls_length_weight.htm.
- מינהל המזון והתרופות האמריקאי, משרד הבריאות ושירותי האנוש. עדכון של הדרישות לחומרים המרכיבים. כלל סופי. רישום הפד. 2011 13 באפריל; 76 (71): 20513-8.
- משרד הרישום הפדרלי, שירות הארכיונים והרשומות הלאומי, מינהל השירותים הכלליים. חוקים ותקנות. רישום הפד. 1968 ינואר; 33 (6): 369.
- Mitkus RJ, King DB, Hess MA, Forshee RA, Walderhaug MO. פרמקוקינטיקה מעודכנת של אלומיניום בעקבות חשיפות תינוקות באמצעות תזונה וחיסונים. תַרכִּיב. 2011 בנובמבר 28; 29 (51): 9538-43.
- מילר S, רופאים להסכמה מדעת. Erratum ב'פרמקוקינטיקה של אלומיניום מעודכנת בעקבות חשיפות תינוקות באמצעות תזונה וחיסונים'. בתוך: ResearchGate. ברלין (גרמניה): ResearchGate GmbH; 2020 במרץ 6 [מצוטט 2020 במרץ 6]. https://www.researchgate.net/publication/51718934_Updated_Aluminum_pharmacokinetics_following_infant_exposures_through_diet_and_vaccines/comments.
- רופאים להסכמה מדעת. Newport Beach (CA): רופאים להסכמה מדעת. Erratum ב'פרמקוקינטיקה של אלומיניום מעודכנת בעקבות חשיפות תינוקות באמצעות תזונה וחיסונים'; [מצוטט 2020 6 במרץ]. https://physiciansforinformedconsent.org/mitkus-2011-erratum/.
- Flarend RE, Hem SL, White JL, Elmore D, Suckow MA, Rudy AC, Dandashli EA. ספיגה in vivo של תוספי חיסון המכילים אלומיניום באמצעות 26Al. חיסון 1997 אוגוסט-ספטמבר; 15 (12-13): 1314-8.
- Verdier F, Burnett R, Michelet-Habchi C, Moretto P, Fievet-Groyne F, Sauzeat E. בדיקת אלומיניום והערכת התגובה המקומית במספר נקודות זמן לאחר מתן תוך שרירי של חיסונים המכילים אלומיניום בקוף Cynomolgus. תַרכִּיב. 2005 בפברואר 3; 23 (11): 1359-67.
- Weisser K, Göen T, Oduro JD, Wangorsch G, Hanschmann KO, Keller-Stanislawski B. אלומיניום בפלזמה וברקמות לאחר הזרקה תוך שרירית של חיסונים אנושיים מסייעים בחולדות. קשת טוקסיקול. אוקטובר 2019; 93 (10): 2787-96.
- Masson JD, Crépeaux G, Authier FJ, Exley C, Gherardi RK. ניתוח קריטי של מחקרי ייחוס על טוקסיקוקינטיקה של תוספים מבוססי אלומיניום. J Inorg Biochem. אפריל 2018; 181: 87-95.
מאמר תורגם על ידי רופאים להסכמה מדעת
Secondo il CDC americano, i problemi che possono derivare dopo la vaccinazione con il vaccino coniugato pneumococcico 13-valente (PCV13), vaccino pneumococcico polisaccaridico 23-valente (PPSV23) e qualsiasi altro vaccino includono:(1-2)
- Reazioni allergiche gravi che si verificano entro pochi minuti o poche ore dalla vaccinazione.
- Forte dolore alla spalla che limita i movimenti del braccio in cui è avvenuta la somministrazione.
- Svenimento o collasso dopo la vaccinazione. Può essere consigliato di rimanere seduti o sdraiati per circa 15 minuti dopo la vaccinazione per evitare svenimenti e lesioni che potrebbero derivare da una caduta. È importante informare il medico curante in caso di ronzii alle orecchie, alterazioni visive o vertigini dopo la vaccinazione.
Effetti collaterali del vaccino PCV13 (Vaccino Coniugato Pneumococcico)
Le reazioni avverse in seguito alla somministrazione del PCV13 variano in base alla dose della serie e all'età del ricevente. Nei bambini, le reazioni più comunemente segnalate sono state irritabilità, sonnolenza, perdita di appetito, arrossamento, dolore o gonfiore nel sito del vaccino e febbre lieve o moderata.
I bambini che hanno ricevuto il PCV13 contemporaneamente al vaccino antinfluenzale inattivato sono risultati a maggior rischio di convulsioni febbrili.
Negli adulti sono stati segnalati soprattutto arrossamento, gonfiore e dolore nel sito di iniezione, affaticamento, febbre, brividi, mal di testa e dolori muscolari.(3)
Reazioni avverse di Prevenar 13 (PCV13) segnalate nei neonati e nei bambini durante gli studi clinici pre-approvazione:(4) dolore nel sito di iniezione, gonfiore, arrossamento, febbre, diminuzione dell'appetito, aumento e diminuzione del sonno, irritabilità, diarrea, vomito, eruzione cutanea, orticaria, reazione di ipersensibilità che comprende broncospasmo, gonfiore del viso e respiro affannoso, convulsioni, polmonite, gastroenterite, bronchiolite, morte (segnalata come SIDS).
Reazioni avverse di Prevenar 13 (PCV13) riportate negli adulti durante gli studi clinici pre-approvazione:(5) dolore, gonfiore e arrossamento nel sito di iniezione, limitazione dei movimenti delle braccia, febbre, vomito, brividi, dolori muscolari, affaticamento, cefalea, diminuzione dell'appetito, eruzione cutanea, dolori articolari, decesso (i decessi riportati negli studi clinici pre-approvazione includevano decessi per cancro, disturbi cardiaci, peritonite, infezione polmonare da Mycobacterium avium complex e shock settico).
Reazioni avverse di Prevenar 13 (PCV13) riportate dopo la commercializzazione:(6) Cianosi, linfoadenopatia nel sito di iniezione, anafilassi, shock, ipotonia, pallore, apnea, edema angioneurotico, eritema multiforme, prurito nel sito di iniezione, orticaria ed eruzione cutanea.
Gli studi clinici pre-approvazione del primo vaccino pneumococcico coniugato, Prevenar (PCV7), hanno confrontato la sicurezza di Prevenar (PCV7) con un vaccino sperimentale contro la meningite C, compromettendo seriamente la validità scientifica della sperimentazione.
Negli studi clinici precedenti all'autorizzazione di Prevenar (PCV7), i bambini dei gruppi che hanno ricevuto il vaccino pneumococcico hanno sofferto maggiormente di convulsioni, irritabilità, febbre alta e altre reazioni. Nel gruppo Prevenar (PCV7) si sono verificati 12 decessi, tra cui 5 decessi per sindrome della morte improvvisa del lattante (SIDS). Non sono stati completati studi a lungo termine per valutare se il vaccino Prevenar (PCV7), somministrato da solo o in combinazione con altri vaccini, avesse un'associazione con malattie croniche o disabilità, come lo sviluppo di diabete, asma, disturbi convulsivi, difficoltà di apprendimento, ADHD.(7)
Gli studi clinici di sicurezza pre-approvazione di Prevenar 13 (PCV13) hanno confrontato questo vaccino di nuova generazione con il vaccino Prevenar originale (PCV7), un vaccino non adeguatamente studiato per la sicurezza, e nel 2012 sono state segnalate preoccupazioni relative a un legame tra convulsioni febbrili e Prevenar 13 (PCV13).(8-9)
Il PCV13 è risultato associato a un rischio elevato di convulsioni febbrili quando è stato somministrato indipendentemente(10) e quando è stato somministrato in combinazione con il vaccino influenzale inattivato per via parenterale (IIV).(11)
Alcuni studi hanno anche collegato il vaccino PCV alla sindrome di Guillain-Barre,(12) alla polisierosite,(13) alla spalla settica(14) e all'eritema multiforme.(15)
Effetti collaterali del vaccino PPSV23 (Pneumococco polisaccaridico)
Secondo i CDC, circa il 50% dei soggetti che ricevono il vaccino polisaccaridico pneumococcico (PPSV23) manifesta dolore e arrossamento nel sito di iniezione. Anche dolori muscolari, febbre e reazioni localizzate più gravi possono verificarsi dopo la somministrazione del PPSV23.(16)
Reazioni avverse di PNEUMOVAX23 (PPSV23) riportate negli adulti durante gli studi clinici americani pre-approvazione:(17) dolore al sito di iniezione, arrossamento, prurito, lividi e gonfiore, cefalea, brividi, febbre, diarrea, dispepsia, nausea, infezione delle vie respiratorie superiori, mal di schiena, dolore al collo, faringite, dolore muscolare, affaticamento, depressione, colite ulcerosa, dolore toracico, angina pectoris, insufficienza cardiaca, tremore, rigidità, sudorazione, ictus, radicolopatia lombare, pancreatite, infarto del miocardio, morte.
Quasi l'80% dei soggetti che hanno partecipato agli studi clinici pre-approvazione ha manifestato una reazione avversa nel sito di iniezione dopo la rivaccinazione a tre-cinque anni dal vaccino iniziale. Anche il tasso di reazioni avverse sistemiche (cefalea, affaticamento, mialgia) in seguito alla rivaccinazione con PPSV23 è stato più elevato, con il 33% degli adulti di età pari o superiore a 65 anni e il 37,5% degli adulti di età compresa tra 50 e 64 anni che hanno riportato una reazione avversa.(18)
Reazioni avverse di PNEUMOVAX23 (PPSV23) riportate dopo la commercializzazione:(19) Reazioni anafilattoidi, malessere da siero,edema angioneurotico, artrite, artralgia, vomito, nausea, diminuzione della mobilità degli arti, edema periferico nell'arto in cui è avvenuta l'iniezione, febbre, malessere, cellulite, calore nel sito di iniezione, linfoadenopatia, linfoadenite, leucocitosi, trombocitopenia in pazienti con porpora trombocitopenica idiopatica stabilizzata, anemia emolitica in pazienti che hanno avuto altri disturbi ematologici, parestesia, sindrome di Guillain-Barré, radicoloneuropatia, convulsioni febbrili, rash, eritema multiforme, orticaria, reazioni simili alla cellulite.
Sebbene il PNEUMOVAX23 (PPSV23) sia approvato per l'uso nei bambini a partire dai due anni di età con condizioni quali malattie cardiache e polmonari croniche, diabete, impianti cocleari, perdite di liquido cerebrospinale, anemia falciforme, asplenia funzionale o anatomica e immunosoppressione, non sono disponibili informazioni sulla sicurezza o sull'efficacia del vaccino nei bambini dal foglietto illustrativo del vaccino.(20)
Alcuni studi hanno collegato il PPSV23 a reazioni infiammatorie sistemiche(21) בפברואר.(22-23-24-25-26)
ריפרימינטי (לחץ לפתיחה)
- ה-CDC Pneumococcal Conjugate (PCV13) VIS. Nov. 5, 2015
- ה-CDC Pneumococcal Polysaccharide VIS. אפריל 24, 2015
- ה-CDC Pneumococcal Conjugate (PCV13) VIS. Nov. 5, 2015
- FDA Prevnar 13 Package Insert אוגוסט 22, 2017
- שם
- שם
- FDA Pneumococcal 7-Valent Conjugate Vaccine (PREVNAR) - תוספת ליצרן המוצר. אוקטובר 1, 2002
- Hitt, E Prevnar 13 Should Be Watched for Febrile Seizure Risk, FDA Panel Says. Medscape. יאן 31, 2012
- Tse A, Tseng HF, Greene SK, et al. Signal identification and evaluation for risk of febrile seizures in children following trivalent inactivated influenza vaccine in the Vaccine Safety Datalink Project, 2010-2011. תרכיב. 2012 Mar 2;30(11):2024-31
- Baker M, Jankosky C, Yih K et al. The Risk of Febrile Seizures Following Influenza and 13-Valent Pneumococcal Conjugate Vaccines. Open Forum Infect Dis. 2017 Fall; 4(Suppl 1): S464–S465.
- ה-CDC Childhood Vaccines and Febrile Seizures יוני, 20, 2016
- Ravishankar,N Guillain-Barre Syndrome Following PCV Vaccine. J Neurol Neurosurg 4 (1): 134
- Tawfik P, Elie Gertner E, McEvoy CE Severe polyserositis induced by the 13-valent pneumococcal conjugate vaccine: a case report נציג מקרה J. 2017; 11: 142.
- DeRogatis MJ, Parameswaran L, Lee P et al. Septic Shoulder Joint After Pneumococcal Vaccination Requiring Surgical Debridement. HSS J. 2018 Oct;14(3):299-301
- Monastirli A, Pasmatzi E, Badavanis G et al. Erythema multiforme following pneumococcal vaccination. Acta Dermatovenerol Alp Pannonica Adriat. 2017 Mar;26(1):25-26.
- ה-CDC Pneumococcal Polysaccharide VIS. אפריל 24, 2015
- FDA Pneumovax 23 - Pneumococcal Vaccine, Polyvalent. Package Insert דצמבר 30, 2014
- שם
- שם
- שם
- von Elten, KA, Duran LL, Banks TA, et al. Systemic inflammatory reaction after pneumococcal vaccine A case series חיסון נגד חיסון. 2014 Jun 1; 10(6): 1767–1770.
- Huang DT, Chiu NC, Chi H, et al. Protracted fever with cellulitis-like reaction in pneumococcal polysaccharide-vaccinated children. Pediatr Infect Dis J. 2008 Oct;27(10):937-9.
- Yousef E, Mannan S. Systemic reaction to pneumococcal vaccine: how common in pediatrics? Allergy Asthma Proc. 2008 Jul-Aug;29(4):397-9
- Gabor EP, Seeman M. Acute febrile systemic reaction to polyvalent pneumococcal vaccine. JAMA. 1979 Nov 16;242(20):2208-9.
- Hasan S, Yousef M, Shridharani S Severe febrile systemic reaction to pneumococcal vaccine. J Natl מד האגודה. 2005 פברואר; 97 (2): 284–285.
- Lee A, Goyal R, Shan HY. Severe protracted fever following pneumococcal vaccine. Am J Med Sci. 2006 Dec;332(6):351-3.
מאמר זה מסוכם ומתורגם על ידי חיסון לאומי מרכז המידע.

