Het rapport waarin aandacht wordt besteed aan het verbergen van sterfgevallen na vaccinatie na vaccinatie

Twee artsen in New Delhi meldden een poging van een multinationale geneesmiddelenfabrikant om plotselinge sterfgevallen bij pasgeboren baby's te verbergen nadat het vaccin was toegediend. Jacob Puliyel, kinderarts in het ziekenhuis Santo Stefano en C. Sathyamala, een epidemioloog, rapporteerden hun ontdekking in het peer-reviewed Indian Journal of Medical Ethics.
Het vaccin in kwestie, "Infanrix hexa", dat difterie-, tetanus-, pertussis-, hepatitis B-, polio- en type B-griepvaccins combineert, wordt geproduceerd door GlaxoSmithKline (GSK) en werd in oktober 2000 in Europa geïntroduceerd.
Puliyel en Sathyamala ontdekten de verhulling door de gegevens te analyseren in de periodieke veiligheidsupdate-rapporten (PSUR) met betrekking tot het vaccin die de fabrikant GSK regelmatig aan het Europees Geneesmiddelenbureau (EMA) moet verstrekken.
Deze vertrouwelijke veiligheidsrapporten over dit vaccin zijn ontvangen door Puliyel van een Italiaanse onderzoeker die ze heeft verkregen van het EMA onder de Freedom of Information Act - de Italiaanse versie van het recht op informatie in India.
Volgens de analyse hebben artsen geconstateerd dat het laatste "Infanrix hexa" vaccinveiligheidsrapport is ingediend door GSK (2015) heeft de sterfgevallen geannuleerd eerder gerapporteerd door de fabrikant in zijn 16e rapport (2012). Zij merken echter op dat in het rapport niet duidelijk is hoe deze sterfgevallen zijn geannuleerd.
Auteurs Puliyel en Sathyamala merken op dat tien jaar na de publicatie van een artikel van het Centre for Disease Control (CDC) over de relatie tussen MMR en autisme, een van de auteurs William Thompson toegaf dat hij en zijn co-auteurs informatie hadden weggelaten. statistisch significant - d.w.z. dat Afro-Amerikaanse mannen die het MMR-vaccin hadden gekregen vóór de leeftijd van 36 maanden, een verhoogd risico op autisme hadden. Nadat Thompson en zijn collega's bewijs van dit verhoogde risico hadden gevonden, verwijderden ze gegevens van kinderen zonder Georgische geboortecertificaten (en daarom een onevenredig aantal zwarte kinderen gediskwalificeerd) en presenteerden hun gegevens dat er geen verhoogd risico op autisme. Het is onduidelijk of de auteurs van PSUR 19 een soortgelijke terugwerkende kracht met terugwerkende kracht hebben uitgevoerd van de kinderen waarvan is vastgesteld dat ze zijn gestorven in PSUR 16.
"Als deze sterfgevallen niet waren gewist, zou het aantal sterfgevallen na vaccinatie aanzienlijk hoger zijn geweest dan bij toeval werd verwacht. De fabrikant zou aan de EMA moeten toegeven dat hun vaccin de oorzaak was van die overtollige sterfte."
Puliyel en Sathyamala beweren dat de producent 'de schijnbaar gebrekkige cijfers die hij aan regelgevende instanties heeft verstrekt, moet verklaren.
Tot nu toe heeft de fabrikant beweerd dat de na het vaccin gerapporteerde sterfgevallen "toevallig" zijn en dat ze bij deze kinderen zouden hebben plaatsgevonden, zelfs als ze geen vaccinaties hadden gekregen.
In hun tijdschriftcommentaar wijzen Puliyel en Sathyamala er echter op dat hun analyse aantoonde dat 83% van de gerapporteerde sterfgevallen onmiddellijk na vaccinatie in de eerste 10 dagen plaatsvond en slechts 17% in de volgende tien dagen.
"Als het toevallige sterfgevallen waren, dan zouden ze niet allemaal onmiddellijk geclusterd zijn na vaccinatie, maar zouden ze gelijk verdeeld zijn over de periode van 20 dagen."
Puliyel en Sathyamala schrijven dat elk argument dat beweert dat plotselinge sterfgevallen na vaccinatie worden gecompenseerd door levens die door het vaccin worden gered, niet acceptabel is, net zoals het als illegaal zou worden beschouwd om iemand te doden om zijn organen te gebruiken om vijf andere mensen te redden. .
"Het verbergen van sterfgevallen na vaccinatie kan de beoordeling van het veiligheidsprofiel van het vaccin voorkomen of vertragen en dit kan leiden tot onnodige en ethisch te rechtvaardigen sterfgevallen.
De auteurs wijzen erop dat Hexavac - een soortgelijk vaccin vervaardigd door Sanofi Pasteur en ook in 2000 op de markt werd geïntroduceerd in 2005 uit de Europese markt werd gehaald. Gebleken is dat het overlijden van kinderen binnen twee dagen na vaccinatie toenam.
In de Indiase context wijzen de auteurs erop dat de Drug Controller General of India (DCGI) het huidige automatische goedkeuringsbeleid voor alle geneesmiddelen die in de Verenigde Staten en Europa zijn toegelaten, moet heroverwegen. "Dit vertrouwen op basis van due diligence door het EMA kan onjuist zijn en moet worden herzien."
"Pentavac", geproduceerd door het Serum Institute of India en op de markt gebracht in India, is vergelijkbaar met de nu stopgezette Hexavac en Infanrix Hexa die hier worden gerapporteerd, behalve dat het pertussisvaccin voor de hele cel is vervangen door een acellulair vaccin en een zesde component, het injecteerbare poliovaccin. "
In het licht van hun feedback suggereren Puliyel en Sathyamala dat "het absoluut noodzakelijk is dat DCGI op de hoogte is van de PSUR-rapporten die aan het EMA zijn verstrekt en de bezorgdheid die uit deze opmerking naar voren komt."
Het bedrijf
Indian Journal of Medical Ethics Online Eerste publicatie 5 september 2017
Infanrix hexa en plotselinge dood: een evaluatie van de update van de periodieke veiligheidsrapporten die bij het Europees Geneesmiddelenbureau zijn ingediend
JACOB PULIYEL, C SATHYAMALA
Auteurs: Jacob Puliyel (overeenkomstige auteur -
Te citeren: Puliyel J, Sathyamala C. Infanrix hexa en plotselinge dood: een beoordeling van de periodieke veiligheidsupdate-rapporten die zijn ingediend bij het Europees Geneesmiddelenbureau. Indian J Med Ethics. Online gepubliceerd op 5 september 2017. Gecorrigeerd op 9 september 2017 *. DOI: 10.20529 / IJME.2017.079
Manuscript-editor: Mala Ramanathan © Indian Journal of Medical Ethics 2017
Abstract
Er zijn verschillende spontane meldingen geweest van onverwacht plotseling overlijden direct na toediening van Infanrix hexa (gecombineerde difterie, tetanus, acellulair pertussisvaccin, geïnactiveerde poliomyelitis, hepatitis B en Haemophilus influenzae type B). De fabrikant, GlaxoSmithKline (GSK), dient periodieke vertrouwelijke veiligheidsupdate-rapporten (PSUR's) over Infanrix Hexa in bij het Europees Geneesmiddelenbureau (EMA). De laatste is PSUR * 19. Elke PSUR bevat een analyse van waargenomen / verwachte plotselinge sterfgevallen, waaruit blijkt dat het aantal sterfgevallen dat onmiddellijk na immunisatie wordt waargenomen, minder is dan verwacht.
Deze opmerking richt zich op dat aspect van de PSUR dat van invloed is op politieke beslissingen. We hebben de gegevens in de PSUR geanalyseerd. Het is duidelijk dat de sterfgevallen die zijn erkend in PSUR 16 zijn geëlimineerd door PSUR 19. Het aantal sterfgevallen dat onmiddellijk na vaccinatie werd waargenomen bij kinderen ouder dan één jaar was aanzienlijk hoger dan bij toeval werd verwacht zodra de gewiste sterfgevallen waren hersteld en opgenomen in de analyse.
De fabrikant moet de cijfers toelichten die bij de regelgevende instanties zijn ingediend. De door het EMA ondernomen procedures om de waarschuwingen van de fabrikant in de PSUR te evalueren, moeten worden herzien. De Medicines Controller General van India accepteert bijna automatisch door EMA goedgekeurde medicijnen en vaccins. Het EMA moet worden getoetst aan het vertrouwen in toewijding.
Introductie
Op 23 oktober 2000, de marketing van twee zeswaardige vaccins, Infanrix hexa® (GlaxoSmithKline plc-GSK) en Hexavac® (Sanofi Pasteur MSD, SNC), die difterie, tetanus, acellulaire pertussis, hepatitis B, la combineren geïnactiveerde poliomyelitis en influenza Haemophilus type B is geregistreerd in de Europese Unie. Na autorisatie waren er verschillende spontane meldingen van onverwacht plotseling overlijden direct na de toediening van deze zeswaardige vaccins. In 2005 hebben von Kries en collega's (1) een gedetailleerde analyse uitgevoerd waarin zij de waargenomen sterfgevallen direct na vaccinatie vergeleken met de verwachte slachtoffers. Zij vonden dat de gestandaardiseerde mortaliteitsratio (SMR) binnen twee dagen na vaccinatie met Hexavac aanzienlijk was toegenomen bij kinderen die in het tweede levensjaar waren gevaccineerd.
Dit was niet het geval met Infanrix Hexa. Op verzoek van de houder van de vergunning voor het in de handel brengen werd Hexavac in 2005 ingetrokken en bleef Infanrix Hexa in Europa op de markt (2). Volgens de Europese wetgeving is het Europees Geneesmiddelenbureau (EMA) verantwoordelijk voor de bescherming van de volksgezondheid door de evaluatie van geneesmiddelen die het als regelgevende instanties heeft goedgekeurd. Fabrikanten zijn verantwoordelijk voor de werkzaamheid, kwaliteit en veiligheid van hun geneesmiddelen (3).
De Italiaanse rechtbank Nicola Di Leo heeft van 15 tot 16 van GlaxoSmithKline (2009) de periodieke vertrouwelijke beveiligingsupdates (PSUR) 2011 en 4a voor het publiek beschikbaar gesteld (19). De PSUR 17 (waarin de PSUR 18, 19 en 15 zijn opgenomen, gedateerd op 2015 januari 3) is door een Italiaanse onderzoeker van de EMA verkregen op grond van artikel 110196 van de EMA-regels (EMA 2006/30 van 2010 november 5) (1 ). De Italiaanse arts stuurde deze PSUR naar de eerste auteur (JP) en vroeg hem een rapport te schrijven dat aan het Europees Parlement moest worden voorgelegd. Dit commentaar is gebaseerd op al deze PSUR's. In de context van het veiligheidsaspect dat eerder door von Kries werd benadrukt (XNUMX), onderzoekt deze opmerking plotselinge dood na het gebruik van het Infanrix Hexa-vaccin. Andere aspecten die in de PSUR worden behandeld, worden niet onderzocht.
PSUR 15 - groepering van doden na vaccinatie
De meeste sterfgevallen die zich voordoen in de post-neonatale periode zijn te wijten aan infecties, aangeboren afwijkingen, maligniteiten of ongevallen. Kinderen sterven zelden zonder een voor de hand liggende oorzaak en daarom worden sterfgevallen geclassificeerd als (i) wiegendood (SIDS), in de PSUR gedefinieerd als sterfte die optreedt in het eerste levensjaar en na de autopsie onverklaarbaar blijft, of (ii) ) onverwachte plotselinge dood (ZUID), gedefinieerd als de dood die optreedt binnen de eerste twee levensjaren, en die onverklaard blijft na klinische en laatste geschiedenis van gebeurtenissen, maar zonder autopsie. Samen worden deze twee beschouwd als plotselinge dood (SD) in PSUR 15. Een bepaald aantal vaccins wordt gegeven aan kinderen jonger dan 2 jaar op een bepaalde dag, en het aantal wereldwijd gevaccineerde kinderen is zeer groot. Het is mogelijk dat sommige gevaccineerde kinderen per ongeluk aan SIDS / SOUTH kunnen overlijden, dergelijke gebeurtenissen zouden zelfs hebben plaatsgevonden als deze kinderen op die dag niet waren gevaccineerd. Om na te gaan of een dergelijke dood werd veroorzaakt door vaccinatie of een incident was, wordt een waargenomen / verwachte SD-analyse uitgevoerd. De analyse beoordeelt of het aantal waargenomen sterfgevallen na vaccinatie groter is dan wat per toeval kan worden voorspeld.
Plotselinge sterfgevallen: waargenomen ten opzichte van verwachtingen
PSUR 15 legt uit hoe deze analyse werd uitgevoerd (4: p 782): "Het Genootschap heeft beoordeeld of het aantal plotselinge sterfgevallen in deze leeftijdsgroep dat hoger was dan nummer één willekeurig kon voorkomen. Sinds de leeftijdsverdeling bij welke proefpersonen gevaccineerd waren niet bekend is, ging het bedrijf ervan uit dat het aandeel van de bijwerkingen naar leeftijd representatief is voor de feitelijke leeftijdsverdeling bij vaccinatie. Daarom kan worden geschat dat 90,6% van alle Infanrix-ontvangers Hexa bevond zich in hun eerste levensjaar en 9,4% bevond zich in het tweede levensjaar. Daarom werd het aantal doses (sinds de lancering) geschat op respectievelijk 54.927.729 en 5,698,904. Omdat Duitsland de belangrijkste land waar Infanrix Hexa-doses worden gedistribueerd (bijna 30% alleen in Duitsland), werd aangenomen dat de incidentie van plotselinge dood die in Duitsland werd waargenomen representatief was voor de gehele ontvangende populatie van Infanrix Hexa (Federaal BureauDuitse statistieken, Statistisches Bundesamt; incidentie in het eerste levensjaar: 0,454 / 1000 levendgeborenen; tweede jaar: 0.062 / 1000 levendgeborenen, gegevens van 2008).
"De PSUR documenteert het gerapporteerde overlijden binnen 20 dagen na vaccinatie. Het waargenomen sterftecijfer was lager dan verwacht (tabel 1).
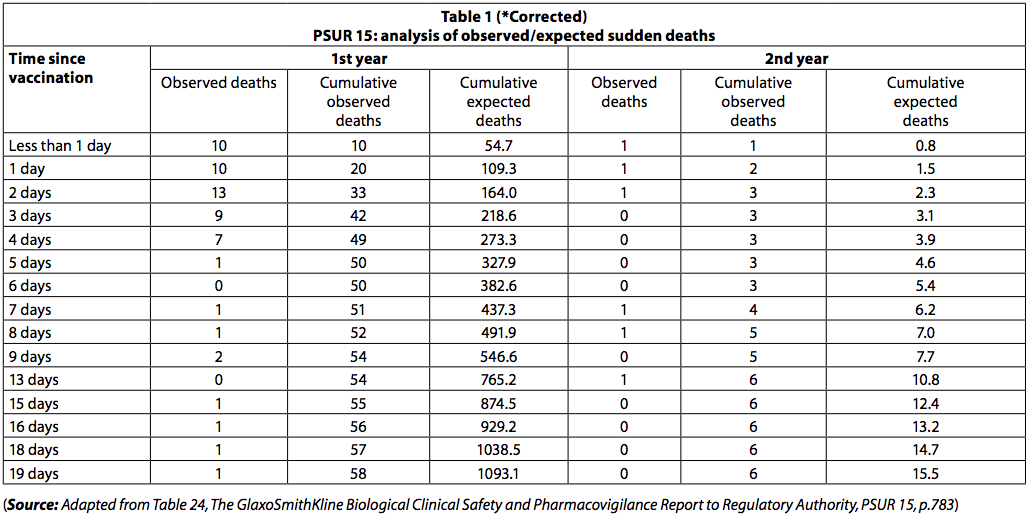
Onder pasgeborenen was er echter een clustering van sterfgevallen onmiddellijk na vaccinatie, met 42 sterfgevallen in de eerste drie dagen na vaccinatie en slechts 8 in de volgende 3 dagen. Onder degenen jonger dan een jaar vielen 54 doden (93%) in de eerste tien dagen en 4 (7%) in de volgende 10 dagen. Als de sterfgevallen "willekeurige SIDS-sterfgevallen" waren geweest, zou deze ongelijkheid in het aantal sterfgevallen over de twee tijdsperioden niet zijn waargenomen.
Het aantal sterfgevallen door wiegendood zou gelijk zijn verdeeld over de periode van 20 dagen.
Het feit dat het sterftecijfer snel daalt met het verstrijken van de tijd na immunisatie suggereert dat de sterfgevallen verband kunnen houden met vaccinatie.
Evenzo kwamen bij kinderen ouder dan een jaar 5 sterfgevallen (83,3%) voor in de eerste 10 dagen en één sterfte (17%) in de volgende 10 dagen. De groepering van sterfgevallen gerapporteerd in PSUR 15 werd ook genoteerd in PSUR 16, en dit is eerder opgemerkt (6).
Antwoord van GlaxoSmithKline
In reactie op deze kritiek (7) suggereerde de Chief Executive Officer (CEO) Sir Andrew Witty van GlaxoSmithKline (GSK) via Dr.Norman Begg, de Chief Medical Officer van het bedrijf, in een brief dat er veel meer kans is een mogelijk oorzakelijk verband te bedenken en vervolgens een bijwerking aan GSK te melden als het kort na vaccinatie optreedt in plaats van weken later. Hij schreef verder: "In het licht van het bovenstaande blijven we vertrouwen in de conclusies die eerder door GSK zijn getrokken en gedeeld met regelgevende instanties en gezondheidsautoriteiten over de hele wereld, dat de momenteel beschikbare gegevens niet wijzen op een verhoogd risico op wiegendood na vaccinatie met Infanrix hexa. Mocht de beschikbare gegevens en informatie veranderen en suggereren dat er een verhoogd risico is, dan blijven we ons inzetten om de autoriteiten onmiddellijk op de hoogte te stellen en de nodige maatregelen te nemen om dergelijke gegevens en informatie door te geven aan zorgverleners. "
Deze reactie bevat een stilzwijgende erkenning dat er geen actieve waakzaamheid was tijdens de post-vaccinatieperiode en alleen sterfgevallen die spontaan aan GSK werden gemeld, werden opgenomen onder de rubriek "waargenomen sterfgevallen". Dit kan een onderschatting van sterfte na vaccinatie veroorzaken. Opgemerkt moet worden dat het aantal verdeelde vaccin doses wordt gebruikt voor "verwachte sterfgevallen". Het rapport erkent dat niet alle doses van het gedistribueerde vaccin zijn gebruikt. Op deze manier werd het aantal "verwachte sterfgevallen" opgeblazen.
Gezien de verklaring en de verzekering van de CEO dat GSK zich ertoe heeft verbonden de autoriteiten en beroepsbeoefenaren in de gezondheidszorg onmiddellijk in kennis te stellen van een verhoogd risico met Infanrix Hexa, is de kwestie van het groeperen van sterfgevallen niet nader onderzocht.
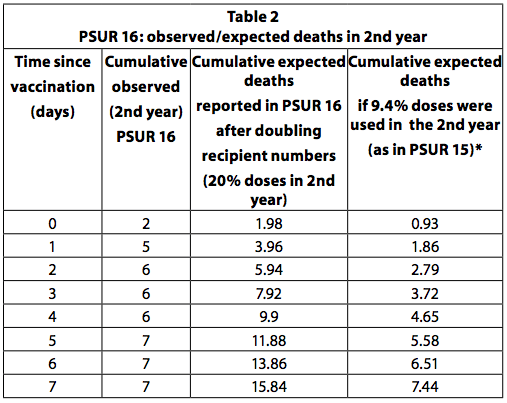
PSUR 16: verdubbeling van verwachte sterfgevallen
Als alle kinderen die de eerste dosis van het vaccin hebben gekregen in totaal vier doses krijgen en de laatste dosis in het tweede levensjaar wordt toegediend, kan worden geschat dat een kwart (25%) van de doses aan oudere kinderen wordt toegediend. tot een jaar. Dit is het aanbevolen vaccinatieschema in Duitsland. Sommige landen, zoals Italië, bevelen echter slechts drie doses aan, allemaal in het eerste jaar en geen enkele in het tweede. Bovendien ontvangen niet alle kinderen alle aanbevolen doses. Het is dus onwaarschijnlijk dat 20-25% van de doses in het tweede jaar zal worden gebruikt. In PSUR 15 werd geschat dat 90,6% van de verkochte doses werd gebruikt bij zuigelingen jonger dan één jaar en 9,4% voor kinderen ouder dan één jaar. In PSUR 16 is de schatting van de ontvangen doses in het tweede jaar meer dan verdubbeld (van 9,4% tot 20%), en daarom is de schatting van de verwachte sterfgevallen verdubbeld. Ondanks de verdubbeling van de verwachte sterfgevallen was het aantal waargenomen sterfgevallen in het tweede jaar hoger dan verwacht in de eerste 3 dagen na vaccinatie (Tabel 36, p249). Als de schatting in PSUR 15 dat 9,4% van de doses in het tweede jaar wordt gebruikt correct is, is dit ook van toepassing op PSUR 16, en daarom zijn de waargenomen sterfgevallen hoger dan de verwachte sterfgevallen in de eerste 7 dagen.
PSUR 19: voorspelde sterfgevallen gewogen per land en per jaaraandeel van doses
In PSUR 19 werd een kalendergewogen gemiddelde van de incidentiecijfers van plotselinge sterfgevallen uit Duitsland, Frankrijk en Nederland berekend om te komen tot de verwachte incidentie van plotselinge sterfgevallen.
In zeer eenvoudige bewoordingen betekent dit dat als 60% van de doses in een bepaald jaar in Duitsland werd verdeeld, het SD-percentage (Sudden Death) in Duitsland bij de berekening van het SD-percentage een gewicht van 60% kreeg. algemeen voor dat jaar; als 30% in Frankrijk werd verdeeld, droeg het SD-tarief in Frankrijk 30% bij en werd het gewicht van 10% gegeven aan het Nederlandse SD-tarief. Ten slotte werd het wereldwijde SD-tarief voor alle jaren samen berekend.
Het totale SD-percentage werd berekend als 0.0102 / 1000 levendgeborenen voor het tweede jaar. Dit cijfer is een zesde van de verwachte frequentie die wordt gebruikt in PSUR 15 en 16 (die plotselinge sterfgevallen berekende op 0,062 / 1000 levendgeborenen, met behulp van Duitse gegevens).
Het Poisson-betrouwbaarheidsinterval (BI) van 95% van de sterfgevallen waargenomen in het tweede jaar wordt gerapporteerd in tabel 8 ap 447 van de PSUR 19. Het is gemeld dat voor het tweede levensjaar het aantal waargenomen sterfgevallen hoger was, ook indien niet significant, dan dat van verwachte sterfgevallen binnen een risicoperiode van 1-4 dagen na vaccinatie.
Ontbrekende sterfgevallen in PSUR 19
Van PSUR 16 tot PSUR 19 stegen de totale vaccindoses van 69 naar 112 miljoen. Volgens de PSUR 19 werd aangenomen dat 20,2% van de verdeelde doses werd toegediend aan kinderen in het tweede levensjaar (PSUR 19, pp 436-448). Gevallen van overlijden waarbij de vaccinatiegraad niet bekend was, de datum van overlijden niet werd geregistreerd of het tijdstip van overlijden langer was dan 19 dagen na vaccinatie, werden uitgesloten.
De PSUR 19 (sterfgevallen tot 22 oktober 2014) rapporteert niet de plotselinge sterfgevallen genoemd in PSUR 16 (sterfgevallen die plaatsvonden tot 22 oktober 2011). Opgemerkt moet worden dat in PSUR 16 de leeftijd van het kind dat stierf na vaccinatie en het tijdstip van overlijden (binnen 14 dagen na vaccinatie) beide werden geregistreerd.
De gerapporteerde cumulatieve sterfgevallen zijn lager bij PSUR 19 dan bij PSUR 16. Wat betreft kinderen ouder dan een jaar, registreert PSUR 19 het voorkomen van slechts 5 sterfgevallen in de eerste 19 dagen na vaccinatie, terwijl PSUR 16 meldt 8 De cijfers zijn niet consistent met elkaar. We vragen ons af waarom dit zo is.
Tien jaar na de publicatie van het CDC-artikel (Center for Disease Control) waarin de relatie tussen het vaccin tegen mazelen, bof en rubella (BMR) en autisme (8) wordt onderzocht, gaf een van de auteurs, William Thompson, toe dat hij en zijn co-auteurs konden geen statistisch significante informatie tonen dat Afrikaans-Amerikaanse mannen die MMR ontvingen vóór de leeftijd van 36 maanden een verhoogd risico op autisme hadden (9). De auteurs schrapten de gegevens van de kinderen die geen geboorteakte hadden in Georgië (10) om een onevenredig groot aantal zwarte kinderen uit te sluiten, en presenteerden hun gegevens om aan te tonen dat er geen toename was van de risico.
Het is onduidelijk of de auteurs van PSUR 19 op vergelijkbare wijze dode en gedocumenteerde kinderen in PSUR 16 hebben uitgesloten.
Tabel 3 geeft de waargenomen en verwachte sterfgevallen gerapporteerd in PSUR 19 en de sterfgevallen waargenomen na het herstel van de sterfgevallen gerapporteerd in PSUR 16.
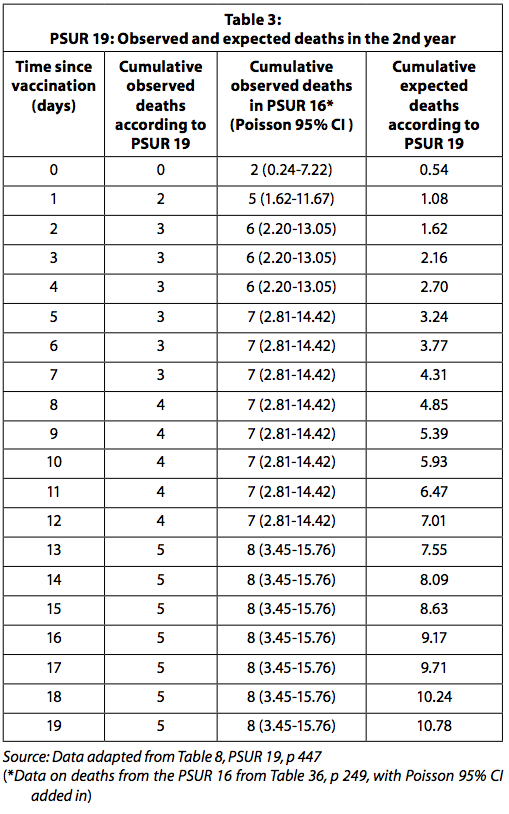
Als de gegevens over geobserveerde sterfgevallen in PSUR 16 worden gebruikt, is het aantal waargenomen sterfgevallen significant hoger dan verwacht gedurende de eerste vier dagen na vaccinatie. Zoals hierboven uitgelegd, moet in gedachten worden gehouden dat, aangezien het aantal waargenomen sterfgevallen passief wordt verzameld, het waarschijnlijk zal worden onderschat. Aan de andere kant worden de verwachte sterfgevallen waarschijnlijk overschat, aangezien ze worden berekend in de veronderstelling dat alle verdeelde doses zonder enig verlies zijn gebruikt en dat er geen vaccin is weggegooid omdat het is verlopen. GSK zou naar verwachting het statistisch significant verhoogde risico op overlijden in de vier dagen na vaccinatie rapporteren aan de regelgevende instantie en artsen.
De doses die in het tweede jaar zijn gebruikt
PSUR 19 gaat ervan uit dat 20,2% van de doses in het tweede jaar is gebruikt. Het stelt dat de verdeling van de leeftijd waarop de proefpersonen worden gevaccineerd onbekend is, en het bedrijf heeft gespeculeerd dat het aandeel bijwerkingen (inclusief overlijden) per leeftijd representatief is voor de werkelijke leeftijdsverdeling bij vaccinatie. Aangezien 20,2% van de bijwerkingen zich voordeden bij kinderen ouder dan één jaar, ging het bedrijf ervan uit dat 20,2% van de doses voor deze leeftijdsgroep is gebruikt.
Het is gemakkelijk om het aantal gebruikte doses in het tweede jaar te schatten op basis van de waargenomen ongewenste voorvallen (inclusief overlijden), gebruik vervolgens deze geschatte dosis om het aantal verwachte sterfgevallen te berekenen en ten slotte te vergelijken met het aantal waargenomen sterfgevallen - gezien het feit dat de schatting van verwachte sterfgevallen wordt voornamelijk berekend op basis van de waargenomen negatieve gebeurtenissen (inclusief sterfte).
Ervan uitgaande dat alle sterfgevallen na vaccinatie samenvallen en niet-causale SIDS / SUD gerelateerd zijn aan het vaccin, en gezien het feit (volgens PSUR 19) is de natuurlijke frequentie van plotselinge dood in het eerste jaar 44 keer hoger dan in het tweede jaar (0.441 / 1000 in het eerste jaar en 0.0102 / 1000 in het tweede jaar), moeten 44 keer meer kinderen in het tweede jaar worden gevaccineerd om hetzelfde aantal sterfgevallen te bereiken als in het eerste jaar.
In een cohort van 100 sterfgevallen, als 20% van plotselinge sterfgevallen in het tweede jaar en 80% in het eerste jaar voorkomen, moeten 880 kinderen in het tweede jaar worden gevaccineerd voor elke 20 gevaccineerde in het eerste jaar. In dit geval zou worden aangenomen dat 44% van alle doses Infanrix hexa in het tweede jaar zou zijn gebruikt en slechts 80% in het eerste jaar (in plaats van andersom). Dit weerspiegelt de absurditeit van het berekenen van de dosisverdeling per leeftijd, gebaseerd op de leeftijdsverdeling van bijwerkingen, zoals gedaan in het GSK-document.
De enige manier om het aantal doses dat in het tweede jaar wordt gebruikt, te evalueren, is door vaccinatieschema's in verschillende landen te bekijken - te bekijken welke landen de vierde dosis in het tweede jaar aanbevelen en welke landen de doses in het tweede jaar niet aanbevelen. Er kan een gewicht worden toegekend voor het aantal doses dat in deze landen wordt verdeeld. De uitval (kinderen die het vaccinatieprogramma verlaten na ontvangst van de eerste doses vaccin) moet ook in aanmerking worden genomen bij de uiteindelijke berekening van het percentage gebruikte doses in het tweede jaar. Het lijkt erop dat een redelijke schatting van de in het tweede jaar gebruikte doses 9,4% van de totale doses is en dit is het cijfer dat wordt gebruikt in de PSUR 15.
Het ethische dilemma - het trolley-probleem
Deze opmerking probeert niet te onderzoeken of deze excessieve sterfgevallen na vaccinatie (vermoedelijk veroorzaakt door het vaccin) kunnen worden gecompenseerd door de levens die door de ziekte zijn gered met de preventie die met het vaccin is verkregen. In zijn klassieke mentale experiment, het trolley-dilemma genoemd, vraagt Philippa Foot of het ethisch is om een trolley te verplaatsen die is ontsnapt van een spoorbaan die vijf mensen zou hebben gedood op een andere baan waar slechts één zou zijn gestorven (11) . In een variant van het kar-dilemma is de enige persoon op het alternatieve spoor het kind van de persoon die van spoor kan wisselen.[2] Judith Thomson neemt aan dat vijf levens kunnen worden gered door orgaantransplantaties van een gezonde donor en vraagt of het ethisch verantwoord is om de ene persoon opzettelijk te doden om de andere vijf te redden (12). Ethiek beweert dat het doel de middelen niet kan rechtvaardigen. Als u na de vaccinatie de dood verbergt, kunt u de beoordeling van het veiligheidsprofiel van het vaccin voorkomen / vertragen en dit kan mogelijk leiden tot meer onnodige sterfgevallen, moeilijk ethisch te rechtvaardigen.
Relevantie voor India
De regulerende instantie van de Indiase overheid is de Drug Controller General of India (DCGI). Volgens de DCGI-regels zijn geneesmiddelen die zijn goedgekeurd in een of meer landen, zoals de Verenigde Staten, het Verenigd Koninkrijk, Canada, Japan, Australië en landen van de Europese Unie, ook goedgekeurd in India (13). Alleen aanvullende studies zijn nodig om de impact van etnische factoren op de werkzaamheid, veiligheid, dosering en doseringsregimes van geneesmiddelen te beoordelen (14).
Onlangs zijn in India studies gepubliceerd die de immunogeniteit en veiligheid van het zeswaardige combinatievaccin onderzoeken in kleine onderzoeken (15,16). Bovendien publiceerde Indian Pediatrics een hoofdartikel met de titel "Hexavalent Vaccinations: The Future of Routine Immunization?" (17), die suggereerde dat dit combinatievaccin in India zou worden gepromoot. Het is van vitaal belang dat de regelgevende autoriteit in India zich bewust is van de zorgen die in dit commentaar op PSUR-rapporten naar voren worden gebracht, vooral omdat de bewakingssystemen in India zwak zijn.
Samenvatting en conclusie
Von Kries (1) rapporteerde een statistisch significante toename van SMR bij kinderen in hun tweede levensjaar, binnen twee dagen na vaccinatie met Hexavac® (een van de twee goedgekeurde zeswaardige vaccins, nu ingetrokken).
In de periodieke veiligheidsupdate-rapporten beoordeelt GSK, het productiebedrijf van Infanrix hexa, of het aantal plotselinge sterfgevallen dat is gemeld na vaccinatie met hun medicijn het aantal heeft overschreden dat bij toeval kon worden verwacht. De groepering van sterfgevallen direct na immunisatie suggereert dat de dood mogelijk door het vaccin is veroorzaakt.
Bovendien laat onze analyse zien dat de sterfgevallen die zijn herkend in PSUR 16 zijn geëlimineerd uit PSUR 19. De waargenomen sterfgevallen worden spontaan gerapporteerd aan GSK en zullen waarschijnlijk worden onderschat. Door toevoeging van sterfgevallen gewist op PSUR 16, is er een statistisch significante toename van het risico op overlijden in de eerste vier dagen na vaccinatie, vergeleken met verwachte sterfgevallen. Fabrikanten moeten uitleggen waarom deze sterfgevallen niet waren opgenomen in PSUR 19. Het verhoogde risico op overlijden is niet bekendgemaakt aan de regelgevende instantie of het zorgpersoneel dat dit vaccin toedient.
Gezien het bovenstaande is het moeilijk te begrijpen hoe EMA PSUR 19 op nominale basis heeft geaccepteerd. Men zou kunnen stellen dat geen zorgvuldigheid is betracht, waardoor veel kinderen onnodig aan het risico van overlijden zijn blootgesteld.
DCGI moet bewust worden gemaakt van de beperkingen in de Infanrix Hexa PSUR.

